| Eisen 26Fe | |||
| engl. Iron; lat. ferrum („Eisen“) | |||
|
Obwohl
Eisen
das bedeutendste aller Gebrauchsmetalle ist, kann man reines
Eisen gar
nicht so leicht beschaffen. Es wird fast immer als Roheisen
mit einem eher
hohen Kohlenstoffgehalt oder als schmiedbarer Stahl mit einem
geringeren
Kohlenstoffanteil gehandelt. Reines, von Kohlenstoff freies
Eisen
glänzt silbrig, es ist besonders gut dehnbar und relativ
weich. Die
mechanische Bearbeitbarkeit nimmt bei Rotglut noch mehr zu, so
dass sich
ein glühendes Eisen-Schwert
besonders
gut schmieden und verformen lässt. Es sind unter Normaldruck drei Modifikationen des festen Eisens bekannt: Bei Raumtemperatur liegt kubisch-raumzentriertes α-Eisen vor (Ferrit). Zwischen 906 °C und 1401 °C erhält man kubisch-flächenzentriertes γ-Eisen (Austenit). Oberhalb 1401 °C bis zum Schmelzpunkt bei 1538 °C liegt kubisch-raumzentriertes δ-Eisen vor (δ-Ferrit). Die Kenntnis über diese Modifikationen ist beim Härten von Stahl von Bedeutung: Im γ-Eisen kann sich Kohlenstoff besser lösen, der in der enthaltenen Zementit-Legierung Fe3C des Stahls enthalten ist. Beim Abschrecken findet keine vollständige Rückverwandlung in das kubisch-raumzentrierte α-Eisen statt. Die Kohlenstoff-Atome werden nicht mehr in die Zementit-Struktur eingebunden. Sie führen zu Störungen im Kristallgitter. Dadurch wird die Stahl-Legierung härter, dafür aber auch wesentlich spröder.
Bei Raumtemperatur ist reines Eisen ferromagnetisch. Oberhalb seiner Curie-Temperatur von 1043 Kelvin (+769,85 °C) wird es paramagnetisch. Bei noch höheren Temperaturen verliert reines Eisen seine magnetischen Eigenschaften ganz. Kohlenstoffhaltiges Eisen ist dagegen immer magnetisierbar. Die Eigenschaften des Metalls werden durch den Zusatz anderer Metalle und vor allem durch Kohlenstoff in Legierungen stark beeinflusst. Schmiedbarer Stahl besitzt weniger als 1,7 Prozent Kohlenstoff. Roheisen ist aufgrund seines hohen Kohlenstoffgehalts von 1,7 bis 4 Prozent zu spröde.
Das Metall
Eisen ist geruch- und geschmacklos. Der typische metallische
Eisen-Geschmack beim Lecken am Metall und auch der Geruch bei
Berührung mit der Haut kommen durch eine Reaktion des Metalls mit
dem Hautschweiß oder dem Speichel zustande. Dabei entstehen
lösliche Eisensalze, die Eisen-Ionen enthalten. Diese sind für
das Phänomen verantwortlich. Der Blutfarbstoff Hämoglobin
ist für den Sauerstofftransport zuständig. Er ist aus einem
Komplex aufgebaut, in dem Eisen(II)-Ionen chemisch gebunden sind.
Deshalb schmeckt auch Blut „nach Eisen“.
Eisen ist ein eher unedles Metall, es ist gut oxidierbar. An trockener Luft ist das kompakte Metall beständig, da sich eine Oxidschicht bildet, die das darunter liegende Eisen schützt. Ganz feines und sehr reines Eisenpulver ist sogar pyrophor, es kann sich an der Luft von selbst entzünden. Streut man Eisenpulver in eine Brennerflamme, dann verglüht es mit Leuchterscheinungen.
An feuchter Luft und
vor allem in Sauerstoff- und CO2-haltigem Wasser oxidiert auch
kompaktes Eisen leicht unter Bildung von Rost. Das
Reaktionsschema gibt den komplizierten Rostvorgang stark vereinfacht wieder:
Eisen + Wasser + Sauerstoff Das Eisenhydroxid reagiert
dann mit dem Luftsauerstoff zu Eisen(III)-oxid Fe2O3 weiter. Daneben entstehen auch andere Eisenoxide wie Eisen(II,III)-oxid Fe3O4 oder Eisen(II)-oxid FeO.
In Salzsäure oder in verdünnter Schwefelsäure löst sich Eisen unter Bildung von Wasserstoff und der entsprechenden
Salze:
Fe + 2 HCl Bei konzentrierter Schwefelsäure
und konzentrierter Salpetersäure ist das Eisen infolge Passivierung beständig, so dass man diese in
eisernen Gefäßen und Rohren aufbewahren oder transportieren
kann. Dieses Phänomen kann dadurch erklärt werden, dass sich
mit den oxidierend wirkenden Säuren eine sehr regelmäßige,
aber dünne Oxidschicht bildet, die das Eisen vor Zersetzung schützt.
Eisen bildet zahlreiche Verbindungen, mit heißem Chlor entsteht Eisen(III)-chlorid FeCl3, mit Schwefel Eisen(II)-sulfid FeS und mit Sauerstoff Eisen(II,III)-oxid Fe3O4:
3 Fe + 2 O2 2 Fe + 3 Cl2
Eisen-Ionen
treten am häufigsten in den Oxidationsstufen
+2 und +3 auf. Es existieren Ionen in Verbindungen mit den
Oxidationsstufen von −2 bis +6,
viele dieser Eisenverbindungen sind aber nicht besonders stabil. Zu den
Eisen(II)-verbindungen mit Eisen(II)-Ionen zählen zum Beispiel Eisen(II)-chlorid, Eisen(II)-sulfat oder Eisen(II)-sulfid, während Eisen(III)-chlorid oder Eisen(III)-oxid häufig benutzte Eisen(III)-verbindungen sind. Eisendihydroxid Fe(OH)2
kann man durch Ausfällen einer Eisen(II)-salz-Lösung mit
Natronlauge unter Luftabschluss in sauerstofffreiem Wasser herstellen.
Das weiße Eisendihydroxid oxidiert sehr leicht mit Sauerstoff
über mehrere Zwischenverbindungen zu rotbraunem Eisentrihydroxid
Fe(OH)3. Gelöste Eisen(II)-Ionen kann man mit rotem Blutlaugensalz nachweisen. Beim Stoffmengenverhältnis eins zu eins entsteht kolloidal gelöstes Berlinerblau: a) Fe2+ + K3[FeIII(CN)6] Mit Eisen(III)-Ionen bildet dagegen das gelbe Blutlaugensalz Berlinerblau: b) Fe3+ + K4[FeII(CN)6] Unlösliches Berlinerblau Fe4III[FeII(CN)6]3 fällt in der Reaktion b) aus, wenn Fe3+-Ionen im Überschuss eingesetzt werden. Unlösliches Turnbulls Blau [FeII(CN)6]4− + Fe4III[FeII(CN)6]3 entsteht nach der Reaktion a) bei Überschuss der Fe2+-Ionen. [Lit 121] Die beiden unlöslichen Komplexe werden als blaue Pigmente benutzt. Eisen(III)-Ionen können auch mit Kaliumthiocyanat nachgewiesen werden. In einer sehr empfindlichen Reaktion entsteht rotes Eisenthiocyanat: Fe3+ + 3 SCN−
|
Im
menschlichen Körper finden sich die Eisenverbindungen vor allem im
Blut bei den Erythrozyten, den roten Blutkörperchen. Der rote Blutfarbstoff
Hämoglobin ist aus einem Eisen-Protein aufgebaut. An das im Chelat-Komplex
gebundene Fe2+-Ion im Hämoglobin-Molekül kann sich Sauerstoff
binden. Dadurch sind der Sauerstofftransport und die -speicherung im Blut
gewährleistet. Darüber hinaus gibt es einige Enzymgruppen im
Energiestoffwechsel, bei denen Eisen-Atome eingebunden sind.
Bei Mangelerscheinungen
treten Symptome wie Blutarmut, häufige Müdigkeit, blasse Haut,
Kopfschmerzen, Entzündungen an der Zunge und in der Speiseröhre
oder Risse in den Mundwinkeln auf. Kinder in der Wachstumsphase oder schwangere
Frauen benötigen mehr Eisen. Ein Mangel kann auch durch einen chronischen
Durchfall, durch Blutverlust oder durch entzündliche Darmerkrankungen
auftreten. Aber auch eine Überdosierung ist möglich, wenn eine
genetisch bedingte Eisenstoffwechselstörung vorliegt. Diese ist gar
nicht so selten, denn etwa eine Person von 300 bis 400 Personen ist davon betroffen. [Lit 16] Bei
Eisenmangel wirkt sich das Essen von Austern, Hirse, Linsen, weißen
Bohnen, Leber, Haferflocken oder Reis als besonders günstig aus. |
Häufigkeit sehr häufig
Eisen steht mit 4,7% an vierter Stelle der Elementhäufigkeit in der Erdhülle. In der Natur kommt es in gediegener Form sehr selten vor. In Meteoriten ist es häufig enthalten. Zu den bedeutenden Eisenerzen zählen der Hämatit, der Magnetit, der Siderit oder das Gestein Limonit, das hauptsächlich aus den Mineralien Goethit und Lepidokrokit aufgebaut ist. Die bedeutendsten Erzvorkommen liegen in China, Australien, Brasilien, Indien, Russland oder in der Ukraine. In Deutschland kommen Eisenerze im Lahn-Dill-Gebiet in Hessen oder bei Salzgitter vor. Die Erzreserven werden weltweit auf über 115 Milliarden Tonnen geschätzt. Das Bild unten zeigt einen Eisen-Meteoriten, der in Gibeon, in Namibia gefunden wurde und vor ungefähr 30000 Jahren auf der Erde einschlug. Sein Alter wird auf 4,5 Milliarden Jahre geschätzt. Er enthält neben Eisen einen Nickel-Anteil von 6,8 Prozent, einen Cobalt-Anteil von 0,4 Prozent und einen winzigen Iridium-Anteil. Nach dem Schleifen wird der metallische Charakter des Meteoriten sichtbar. Nach dem Ätzen mit 5%iger alkoholischer Salpetersäure treten die für einen Meteoriten typischen „Widmannstättenschen Gefüge“ sichtbar. Es handelt sich dabei um eine Mischung mehrerer Eisen-Modifikationen. Die beim nickelarmen α-Eisen ausgebildeten Balken werden seitlich von nickelreichem γ-Eisen („Bandeisen“) begrenzt. Sind die beiden Eisen-Modifikationen nach dem Oktaeder verwachsen, erhält man nach dem Ätzen die beschriebenen Figuren:
|
Die
Eisenerzlagerstätten sind sedimentär in der Frühgeschichte
der Erde entstanden, als die eisenhaltigen Meteoriten in den Urmeeren am
Meeresboden durch Bakterien und biologische Abbauprozesse in Eisensalze
umgewandelt wurden. Der Name Eisen und das englische iron könnten ihren Ursprung in keltischen Flussnamen, wie Isarno, Isarkos,
Eisack oder Eisen haben. Andere Quellen sehen den Ursprung im keltischen Isara („stark, fest“). Der lateinische Name ferrum stammt von dem
lateinischen Wort ferreus („kräftig, hart, schwer“) ab.
Das Symbol Fe führte J.J. Berzelius im Jahre 1814 ein. In der Alchemie
war das Eisen dem Planeten Mars zugeordnet und verkörperte im Gegensatz
zum Kupfer das männliche Prinzip. Es erhielt
daher das Marszeichen (erstes Symbol von links):
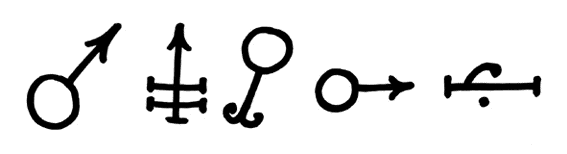
Eisen als Metall war bereits in der Antike bekannt. Die Eisenzeit begann nach der Bronzezeit etwa um 1400 vor Christus. Als Erfinder der Eisengewinnung aus Eisenerz gelten die Chalyber, die Untertanen der Hethiterkönige waren. Sie lebten an der Südküste des Schwarzen Meeres und verhütteten Eisenerz mit Hilfe der Holzkohle aus dem Holz der Gebirgswälder des nordostanatolischen Gebirges. Die Chalyber erfanden auch ein Verfahren zum Härten des Eisens auf der Oberfläche. Das gehärtete Eisen erwies sich härter als Bronze, so dass die Bronze zunehmend an Bedeutung für Werkzeuggeräte und Waffen verlor. Das Eisen war auch leichter herzustellen als Bronze und die benötigten Rohstoffe waren in großen Mengen verfügbar. [Lit. 135]
Die Technologie kam um 500 vor Christus nach Europa. Eine Eisenindustrie entstand erst im 7. Jahrhundert nach Christus in der Steiermark, später in Thüringen und Sachsen. Die Verkohlung des Buchenholzes zu Holzkohle erfolgte im Mittelalter in aufgeschichteten Kohlenmeilern: Das aufgehäufte Holz wurde luftdicht abgedeckt und entzündet. Die Luftzufuhr wurde durch den Köhler so reguliert, dass das Holz nicht vollständig verbrannte, sondern nur verkohlte und die leicht flüchtigen Bestandteile des Holzes verdampften. Ein weißer, dichter Rauch zeigte an, dass der Verkohlungsprozess noch im Gang war. Wurde er hell und bläulich, war der Prozess abgeschlossen. Schon im Mittelalter holzte man zur Eisenverhüttung ganze Wälder ab.
Bis zum späten Mittelalter wurde das Eisenerz wie bei den Römern in Rennöfen oder in niedrigen Schachtöfen verhüttet. Der trichterförmige Rennofen war mit Steinen und mit Lehm ausgemauert und an einem Berghang angelegt. Der Hangwind erzeugte einen Luftdurchzug, der die Hitze des Rennfeuers erhöhte. Die Luftzufuhr erfolgte später auch mit Blasebälgen. Das Eisen entstand als teigige Masse, dem Eisenschwamm, der auch „Lupe“ oder „Wolf“ genannt wurde. Die flüssige Schlacke erhielt man durch die Zugabe von Kalk, sie „rannte“ aus dem Ofen. Der Eisenschwamm war schmiedbar. [Lit. 148, 149] Der Stückofen war ein viereckig gemauerter, bis zu vier Meter hoher Schachtofen, der oben offen war. Das gebildete Eisen konnte man in Stücken aus dem Ofen herausholen. Die Öfen wurden im Lauf der Zeit immer mehr optimiert. Das Zerkleinern des Eisenerzes übernahmen Pochwerke, die durch Wasserkraft angetrieben wurden. Das Herausschlagen der Schlacke erfolgte durch Hammerwerke, die ebenfalls mit Wasserkraft betrieben wurden. Im 14. Jahrhundert baute man höhere Schachtöfen mit optimierter Luftzufuhr. Wasserkraftgetriebene Blasebälge ermöglichten höhere Temperaturen, so dass sich das Eisen verflüssigte. Diese, bis zu 10 Meter hohen Schachtöfen gelten als Vorläufer des modernen Hochofens.
Der Betrieb eines funktionierenden, mit Koks gefeuerten Hochofens ist seit 1735 durch den englischen Eisenfabrikant Abraham
Darby II (1711−1763) in Shropshire bekannt. Zuvor hatte sein Vater Abraham
Darby I (1676–1717) jahrelang an der Austüftelung des Verfahrens gearbeitet. Während das Holz in England zu jener Zeit dringend für den Schiffsbau benötigt wurde, stand die Steinkohle in großer Menge zur Verfügung. Die Steinkohle wurde in Kokereien unter Sauerstoffabschluss zu Koks verkohlt. Dabei werden die flüchtigen Bestandteile der Steinkohle abgetrennt. Koks hat eine höhere Energiedichte, und er erzeugt beim Verbrennen weniger Rauch. Die von James Watt im Jahr 1769 patentierte Dampfmaschine verbesserte das Gebläse und erhöhte die Leistungsfähigkeit eines Hochofens nochmals erheblich. Erst 1796 gelang es dem Preußischen Hüttenwerk Gleiwitz, den ersten mit Koks betriebenen Hochofen auf dem europäischen Festland in Betrieb zu nehmen. Der englische Erfinder und Metallgießer Benjamin Huntsmann (1704–1776) stellte 1740 erstmals Gussstahl mit Hilfe eines Flussmittels in Tiegeln her. So konnte der Stahl vergossen und die Tiegel wiederverwendet werden. Henry Cort (1740–1800) erfand 1784 das Puddelverfahren: Dabei wurden die im geschmolzenen Roheisen enthaltenen Bestandteile wie Kohlenstoff oder Mangan durch erhitzte Luft verbrannt. Ein Arbeiter – der Puddler – rührte dazu die Schmelze mit langen Stangen ständig um, damit die Luft an die Schmelze kam. Durch die Kontinentalsperre – der Wirtschaftsblockade des Vereinigten Königreichs durch Napoleon Bonaparte – gab es auf dem europäischen Festland von 1806 bis 1813 keinen Gussstahl mehr aus England. Dies regte den deutschen Unternehmer Friedrich Krupp (1787–1826) an, Gussstahl in seinem Betrieb herzustellen, was ihm ab 1816 gelang. Sein Sohn Alfred Krupp (1812–1887) baute ab 1849 die ersten Gussstahlgeschütze. Dadurch verbesserte sich die Feuerkraft der Geschütze erheblich.
Sir Henry Bessemer (1813–1898) gilt als Erfinder der Bessemerbirne, die ab 1856 zum Einsatz kam: Bei dem heute nicht mehr angewendeten Verfahren wurde in einem Gebläseofen Luft in das geschmolzene Roheisen geblasen. Der Vorgang erfolgte in einem birnenartigen Gefäß, das mit feuerfesten Ziegeln ausgekleidet war und das man kippen konnte. Die Erfindung des gezogenen, innen schraubenartig gedrehten Laufs bei Gewehren und Geschützen ermöglichte eine wesentlich höhere Treffsicherheit. Diese Konstruktion konnte erst durch den gießbaren Stahl aus der Bessemerbirne verwirklicht werden. Sidney Thomas (1850–1885) verbesserte zusammen mit seinem Vetter, dem Chemiker Percy Carlyle Gilchrist (1851-1935) das Blasverfahren ab 1876. Beim Windfrischen wird Luft von unten durch Bodendüsen in die Thomas-Birne geblasen. Es werden dabei so hohe Temperaturen erreicht, dass auch phosphorhaltiges Roheisen zu Stahl verarbeitet werden kann. Der so hergestellte Thomas-Stahl eignete sich für Eisenbahnschienen oder zum Brückenbau. Der Nachteil des Verfahrens bestand darin, dass der Luftstickstoff mit dem Eisen Nitride bildet, die die Zähigkeit des Stahls herabsetzen. Die Verfahren zur Stahlherstellung verbesserten sich kontinuierlich, 1904 wurde der erste Elektroofen zur Stahlerzeugung in Betrieb genommen. Eine befriedigende Stahlqualität brachte erst das Sauerstoffblasverfahren, das auf die Vorarbeiten des Schweizer Metallurgen Robert Durrer (1890–1978) aus dem Jahr 1928 zurückgeht. |
Da
Eisen in der Natur nur in Meteoriten elementar vorkommt, muss es durch
eine Reduktion aus Eisenerzen gewonnen werden.
Das bedeutendste Verfahren ist heute der Hochofenprozess.
Im Labor kann man Eisenerz
mit Hilfe von Aluminium reduzieren. Dazu gibt man
ein Gemisch aus rotem gemahlenem Eisenoxid und Aluminiumgrieß in
einen Tontopf und zündet dieses Thermit-Gemisch mit Hilfe einer starken
Wunderkerze. Der Versuch verläuft stark exotherm:
Fe2O3 + Al
|
Eisen
ist das wichtigste Gebrauchsmetall. Während reines Eisen nur selten
eingesetzt wird – zum Beispiel bei der Herstellung der Magnete – sind
zahlreiche Eisenlegierungen als Werkstoffmaterial bekannt. Eisenverbindungen
spielen eine große Rolle als Katalysatoren bei großtechnischen
Prozessen, zum Beispiel beim Haber-Bosch-Verfahren.
Die Eisenoxide werden als Pigmente verwendet. Bei Eisenmangel werden Eisensalze medizinisch verabreicht.
Die Eisenlegierungen werden je nach Zusammensetzung und Einsatzbereich unterteilt. Als Gusseisen bezeichnet man eine Eisenlegierung, die mindestens 2 % Massenanteil an Kohlenstoff enthält. Üblich sind 2,6 bis 3,6 % Massenanteil. Beim Gusseisen mit Lamellengraphit ist der Graphit in mikroskopisch kleinen, lamellenartigen Blättchen eingelagert. Der enthaltene Graphit ist weich, er lässt die Bruchfläche grau erscheinen. Der enthaltene Kohlenstoffgehalt setzt den Schmelzpunkt herab und verursacht eine dünnflüssige Schmelze, die beim Grauguss gut vergossen werden kann. Dadurch können große und aufwändige Werkstücke wie Getriebegehäuse gegossen werden. Das Gusseisen ist hart und spröde, die Zugfestigkeit ist gering, es lässt sich nicht schmieden. Es hat aber gute Gleiteigenschaften, besitzt Formsteifigkeit und kann Schwingungen dämpfen. Beim Gusseisen mit Kugelgraphit liegt der Graphit in Kugelform vor. Diese Gusseisenform besitzt eine höhere Zugfestigkeit, es ist zäher und bricht nicht so schnell. Eingesetzt wird es für große Zahnräder, Kurbelwellen oder Turbinengehäuse. Der Temperguss kommt bereits den Eigenschaften des Stahls schon sehr nahe. Nach dem Gießen werden die Teile einer längeren Wärmebehandlung durch Glühen durch Zugabe von Luftsauerstoff unterzogen. Dies setzt den Kohlenstoffanteil herab, es entsteht ein „weißer Temperguss“, die Bruchfläche glänzt metallisch hell. Solche Metallstücke sind schweißbar. Beim „schwarzen Temperguss“ erfolgt das Glühen unter Ausschluss von Sauerstoff, die Bruchfläche erscheint schwarz. Temperguss wird im Fahrzeug- und Maschinenbau verwendet. Als Stahl wird eine Eisenlegierung mit weniger als 2 % Massenanteil Kohlenstoff bezeichnet. Die Zahl ist nicht willkürlich gewählt: Eisen liegt bis zu einem Prozentgehalt von 2,06 % in der Schmelze in der kubisch-flächenzentrierten Form vor, die als Austenit bezeichnet wird. Diese Modifikation ist gut verformbar. Man kann Stahl nach dem Anteil der Legierungsmengen unterteilen. Unlegierter Stahl enthält relativ geringe Anteile der Legierungselemente wie Aluminium, Chrom, Nickel oder Wolfram. Von den genannten Elementen dürfen zum Beispiel nur maximal 0,3 % enthalten sein. Niedrig legierter Stahl enthält neben dem Eisen bis zu 5 % Anteil an Fremd-Metallen. Chrom, Nickel, Mangan oder Molybdän erhöhen die Zugfestigkeit erheblich. Ist der Stahl aggressiven Chemikalien ausgesetzt – zum Beispiel in einem chlorhaltigen Reaktionsbehälter der chemischen Industrie – dann wird hochlegierter Stahl benötigt. V4A-Stahl enthält neben dem Eisen 18 % Chrom, 10 % Nickel, 2 % Molybdän und wenig Titan. Moderne Schwimmbecken sind aus diesem Stahl aufgebaut.
Baustahl wird für den Stahl- und Maschinenbau eingesetzt. Betonstahl wird als Armierung in der Schalung im Beton vergossen. Es werden oft niedrig legierte Stahlsorten eingesetzt, da diese billig herstellbar sind und trotzdem relativ gute Eigenschaften aufweisen. Die häufigste Methode um Stahl vor der Korrosion zu schützen ist die Feuerverzinkung. Alternativ kann der Stahl auch mit einem Lack versehen oder mit einem Polymer wie Epoxid beschichtet werden. Wetterfester Baustahl enthält geringe Legierungsanteile von Elementen wie Chrom, Kupfer oder Nickel, die eine Patina bilden; dadurch wird Witterungsbeständigkeit erreicht. Dieser Stahl wurde früher häufig für Brücken verwendet. Heute wird austenitischer Edelstahl eingesetzt, der mindestens 8 % Nickel enthält. Er vereint Korrosionsbeständigkeit und die gewünschten mechanischen Eigenschaften optimal. Der Begriff Edelstahl ist mehrdeutig. Im ursprünglichen Sinn ist damit ein Stahl mit besonders hoher Reinheit gemeint. Häufig wird der Begriff aber für nichtrostenden Stahl („Edelstahl rostfrei“) eingesetzt. |
| Thermit-Versuch
und Hochofen-Modellversuch Hochofenprozess und Stahlherstellung Sulfidreaktionen |
|
|