Werdende oder stillende Mütter dürfen mit konzentrierter Salpetersäure nicht arbeiten. Es wird empfohlen, für Schülerversuche in der Sekundarstufe I nur verdünnte Lösungen bis maximal 12 % zu verwenden. Auch in höheren Klassen empfehlen sich für Schülerversuche verdünnte Lösungen. Im Schullabor werden nur Konzentrationen bis maximal 65 % aufbewahrt. Rauchende oder konzentrierte Salpetersäure ist kein Explosivstoff, sie kann aber zur Herstellung von derartigen Stoffen verwendet werden (>Hinweise). Sie wirkt stark ätzend auf Haut und Augen. Das Einatmen der Dämpfe kann zu einem lebensgefährlichen Lungenödem führen. Schutzbrillen, Schutzkittel und Schutzhandschuhe sind für alle Konzentrationen obligatorisch. Es sollte bei allen Arbeiten mit Salpetersäure im Abzug gearbeitet werden. Zur Aufbewahrung der konzentrierten Säure werden Flaschen mit Teflonverschluss oder das Originalgebinde empfohlen. Geeignet sind auch Schraubverschlusskappen aus PBT, die mit PTFE beschichtet sind. Salpetersäure kann beim Erhitzen oder bei der Reaktion mit Metallen toxisches Stickstoffdioxid freisetzen. Experimente mit Stickstoffdioxid sind für Schulen nicht geeignet. Der Privatbesitz von konzentrierter Salpetersäure ist verboten. Frei ist die verdünnte Säure bis 3 %.
Gefährdungsbeurteilung Deutschland (auch EU)
GBU Arbeiten mit Salpetersäure
Sicherheitsbetrachtung Schweiz
SB Arbeiten mit Salpetersäure
Salpetersäure
HNO3
CAS 7697-37-2
Salpetersäure
Nitric acid
Molmasse (reine HNO3)
AGW
pKs-Wert
Dichte (100%)
Schmelzpunkt (100%)
Siedepunkt (100%)
Wasserlöslichkeit
AGW
pKs-Wert
Dichte (100%)
Schmelzpunkt (100%)
Siedepunkt (100%)
Wasserlöslichkeit
63,013 g/mol
1 ml/m3 (TRGS 900)
−1,377
1,513 g/cm3
−41,6 °C
+83 °C
in jedem Verhältnis mischbar
1 ml/m3 (TRGS 900)
−1,377
1,513 g/cm3
−41,6 °C
+83 °C
in jedem Verhältnis mischbar
Farblose oder gelbliche, an der Luft rauchende Flüssigkeit (100%)
Braune Flaschen und Teflonverschluss (konzentrierte Lösungen)

Gefahrenklassen + Kategorie
Oxidierende Flüssigkeiten 2 (>=99%)
Ox. Flüssigkeiten 3 (65 bis 99%)
Ätzw. auf die Haut 1A (>=20%)
Ätzw. auf die Haut 1B (<20%)
Schwere Augenschädigung 1
Akute Tox. 3 (Einatmen) (<=70%)
Akute Tox. 1 (Einatmen) (>70%)
Korrosiv gegenüber Metallen 1
Ätzwirkung auf die Atemwege (EUH)
Oxidierende Flüssigkeiten 2 (>=99%)
Ox. Flüssigkeiten 3 (65 bis 99%)
Ätzw. auf die Haut 1A (>=20%)
Ätzw. auf die Haut 1B (<20%)
Schwere Augenschädigung 1
Akute Tox. 3 (Einatmen) (<=70%)
Akute Tox. 1 (Einatmen) (>70%)
Korrosiv gegenüber Metallen 1
Ätzwirkung auf die Atemwege (EUH)
HP-Sätze (siehe Hinweis)
H 272, 314, 331, 330 (>70%), 290, EUH071
P 260, 280.1–4+7, 303+361+353, 304+340, 305+351+338, 310
Entsorgung Vorbehandlung Säuren/Basen
H 272, 314, 331, 330 (>70%), 290, EUH071
P 260, 280.1–4+7, 303+361+353, 304+340, 305+351+338, 310
Entsorgung Vorbehandlung Säuren/Basen
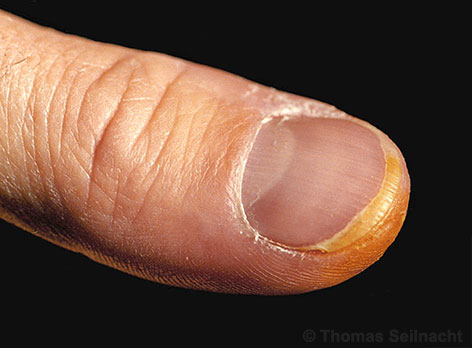
Wirkung auf den menschlichen Körper
Die Lösung und die Dämpfe wirken auf Haut, Augen und Schleimhäute stark ätzend. Das Einatmen führt zu Bronchialkatarrh, Lungenentzündung und Verätzung der Lungenbläschen. Beim Entstehen eines Lungenödems besteht Lebensgefahr. Bei Hautkontakt erfolgt eine Gelbfärbung in einer Xanthoprotein-Reaktion. Dabei bildet sich ein gelber Nitrofarbstoff:
Chemisch-physikalische Eigenschaften
Als „Konzentrierte Salpetersäure“ bezeichnet man die handelsübliche, etwa 65 bis 69%ige Lösung der Salpetersäure in Wasser. Die 100%ige, rote, rauchende Salpetersäure ist im reinen Zustand farblos, wenn sie unter Luftabschluss gekühlt aufbewahrt wird. Die rauchende Salpetersäure zersetzt sich aber schon an der Luft oder beim Sieden unter Bildung von rotbraunem und stark toxischem Stickstoffdioxid, das die Orangefärbung verursacht:

Rauchende Salpetersäure setzt Stickstoffdioxid frei.
Rauchende Salpetersäure ist ein sehr starkes Oxidationsmittel und kann Holz oder Stroh spontan entzünden. Die Dichte variiert bei den unterschiedlichen Konzentrationen. Beim Verdünnen der Säure muss dies berücksichtigt werden. Für den Unterricht in Schulen wird „verdünnte“ und „konzentrierte“ Salpetersäure gebraucht, damit meint man meistens die 12%ige und die 65%ige Salpetersäure. Die „rauchende“ Salpetersäure hat ein hohes Gefahrenpotenzial, sie wird für den Unterricht nicht empfohlen.
Eine 69,2%ige Salpetersäure bildet ein azeotropes Gemisch, das bei 121,8 °C siedet. Die Salpetersäure ist eine relativ starke Säure, sie ist in wässriger Lösung fast vollständig dissoziiert:
Bei der Reaktion mit den Metallen entstehen die Salze der Salpetersäure, die Nitrate. Mit Zink erhält man Zinknitrat, mit Kupfer Kupfer(II)-nitrat. Das bei dieser Reaktion gebildete Stickstoffmonooxid NO reagiert mit Luft sofort weiter zu rotbraunem Stickstoffdioxid NO2.
Bei der Reaktion der konzentrierten Salpetersäure mit Metallen lösen sich Magnesium, Zink, Kupfer und Silber auf. Gold ist dagegen beständig, erst bei der Zugabe von konzentrierter Salpetersäure und von konzentrierter Salzsäure löst sich auch dieses:
Diese beiden Reaktionsprodukte können Gold oder Platin oxidieren. Gold wird zu Tetrachlorogold(III)-säure H[AuCl4] und Platin zu Hexachloroplatin(IV)-säure H2[PtCl6] oxidiert. Diese Stoffe kann man aus der Lösung auskristallisieren lassen, wobei gelbe Nadeln entstehen, die an der Luft zerfließen und sich in Wasser und Alkohol sehr gut lösen. Gibt man zur Tetrachlorogold(III)-säure-Lösung ein starkes Reduktionsmittel wie Zinn(II)-chlorid, entsteht kolloidales Gold, das purpurrot oder violett gefärbt ist. Das Pigment wird auch als Cassius'scher Goldpurpur bezeichnet. Es ist nach dem Arzt Cassius benannt, der es im Jahr 1663 entdeckte. Die Tetrachlorogold(III)-säure dient zur Herstellung anderer Goldverbindungen. Gold(III)-chlorid und gold-organische Verbindungen eignen sich als Katalysator für organische Synthesen. Mit Gold(III)-oxid lassen sich Gläser färben.

Kolloidales Gold
Die Lösung und die Dämpfe wirken auf Haut, Augen und Schleimhäute stark ätzend. Das Einatmen führt zu Bronchialkatarrh, Lungenentzündung und Verätzung der Lungenbläschen. Beim Entstehen eines Lungenödems besteht Lebensgefahr. Bei Hautkontakt erfolgt eine Gelbfärbung in einer Xanthoprotein-Reaktion. Dabei bildet sich ein gelber Nitrofarbstoff:
Chemisch-physikalische Eigenschaften
Als „Konzentrierte Salpetersäure“ bezeichnet man die handelsübliche, etwa 65 bis 69%ige Lösung der Salpetersäure in Wasser. Die 100%ige, rote, rauchende Salpetersäure ist im reinen Zustand farblos, wenn sie unter Luftabschluss gekühlt aufbewahrt wird. Die rauchende Salpetersäure zersetzt sich aber schon an der Luft oder beim Sieden unter Bildung von rotbraunem und stark toxischem Stickstoffdioxid, das die Orangefärbung verursacht:
4 HNO3  4 NO2 + 2 H2O + O2
4 NO2 + 2 H2O + O2
Rauchende Salpetersäure setzt Stickstoffdioxid frei.
Rauchende Salpetersäure ist ein sehr starkes Oxidationsmittel und kann Holz oder Stroh spontan entzünden. Die Dichte variiert bei den unterschiedlichen Konzentrationen. Beim Verdünnen der Säure muss dies berücksichtigt werden. Für den Unterricht in Schulen wird „verdünnte“ und „konzentrierte“ Salpetersäure gebraucht, damit meint man meistens die 12%ige und die 65%ige Salpetersäure. Die „rauchende“ Salpetersäure hat ein hohes Gefahrenpotenzial, sie wird für den Unterricht nicht empfohlen.
| Konzentration, Massenprozent |
Konzentration, Stoffmenge |
Bezeichnung |
Dichte bei 20 °C |
| 100 % | 24,01 mol/l | „rauchend“ | 1,513 g/cm³ |
| 69 % | 15,42 mol/l |
„konzentriert“ | 1,409 g/cm³ |
| 65 % | 14,35 mol/l |
„konzentriert“ | 1,391 g/cm³ |
| 12 % | 2,03 mol/l |
„verdünnt“ | 1,066 g/cm³ |
Eine 69,2%ige Salpetersäure bildet ein azeotropes Gemisch, das bei 121,8 °C siedet. Die Salpetersäure ist eine relativ starke Säure, sie ist in wässriger Lösung fast vollständig dissoziiert:
Salpetersäure + Wasser  Nitrat-Ion + Hydronium-Ion
Nitrat-Ion + Hydronium-Ion
HNO3 + H2O  NO3− + H3O+
NO3− + H3O+
Bei der Reaktion mit den Metallen entstehen die Salze der Salpetersäure, die Nitrate. Mit Zink erhält man Zinknitrat, mit Kupfer Kupfer(II)-nitrat. Das bei dieser Reaktion gebildete Stickstoffmonooxid NO reagiert mit Luft sofort weiter zu rotbraunem Stickstoffdioxid NO2.
3 Zn + 8 HNO3  3 Zn(NO3)2 + 4 H2O + 2 NO
3 Zn(NO3)2 + 4 H2O + 2 NO
3 Cu + 8 HNO3  3 Cu(NO3)2 + 4 H2O + 2 NO
3 Cu(NO3)2 + 4 H2O + 2 NO
Bei der Reaktion der konzentrierten Salpetersäure mit Metallen lösen sich Magnesium, Zink, Kupfer und Silber auf. Gold ist dagegen beständig, erst bei der Zugabe von konzentrierter Salpetersäure und von konzentrierter Salzsäure löst sich auch dieses:
Scheidewasser und Königswasser
Salpetersäure ist neben Salzsäure und Schwefelsäure eine der stärksten Säuren und zersetzt sogar Edelmetalle wie Silber. Nur Gold und Platin sind beständig. Da man mit einer 50%igen Salpetersäure Silber aus Gold herauslösen kann, wurde diese Lösung früher auch als Scheidewasser bezeichnet. Vermischt man ein Volumenteil konzentrierte Salpetersäure mit drei Volumenteilen konzentrierter Salzsäure, entsteht Königswasser. Beim Zusammenmischen der beiden Säuren entstehen im Königswasser naszierendes Chlor und Nitrosylchlorid NOCl:
HNO3 + 3 HCl  2 Clnasc. + NOCl + 2 H2O
2 Clnasc. + NOCl + 2 H2O
Diese beiden Reaktionsprodukte können Gold oder Platin oxidieren. Gold wird zu Tetrachlorogold(III)-säure H[AuCl4] und Platin zu Hexachloroplatin(IV)-säure H2[PtCl6] oxidiert. Diese Stoffe kann man aus der Lösung auskristallisieren lassen, wobei gelbe Nadeln entstehen, die an der Luft zerfließen und sich in Wasser und Alkohol sehr gut lösen. Gibt man zur Tetrachlorogold(III)-säure-Lösung ein starkes Reduktionsmittel wie Zinn(II)-chlorid, entsteht kolloidales Gold, das purpurrot oder violett gefärbt ist. Das Pigment wird auch als Cassius'scher Goldpurpur bezeichnet. Es ist nach dem Arzt Cassius benannt, der es im Jahr 1663 entdeckte. Die Tetrachlorogold(III)-säure dient zur Herstellung anderer Goldverbindungen. Gold(III)-chlorid und gold-organische Verbindungen eignen sich als Katalysator für organische Synthesen. Mit Gold(III)-oxid lassen sich Gläser färben.
Kolloidales Gold
Die Herstellung von Salpetersäure kommt schon bei den mittelalterlichen Alchimisten wie Geber vor. In dem Werk De inventione veritatis („Von der Entdeckung der Wahrheit“, erschienen vermutlich im 14. Jahrhundert) wird das Erhitzen einer Mischung aus Kupfervitriol (Kupfersulfat), Alaun (Kaliumaluminiumsulfat) und Salpeter (Kaliumnitrat) auf Rotglut beschrieben. Die dabei entstehenden (nach heutigem Wissen) nitrosen Gase ließen sich mit Wasser zur Salpetersäure umsetzen. Die Herstellung von Königswasser aus Salpetersäure und Ammoniumchlorid geht vermutlich bis in die Zeit vor dem Mittelalter, bis zu den arabischen Alchimisten im 7. oder 8. Jahrhundert zurück. In den Raimundus Lullus untergeschobenen pseudo-lullischen Schriften wird um das Jahr 1332 die Wirkung der Salpetersäure auf Metalle, die Herstellung von Scheidewasser („aqua fortis acuta“) und von Königswasser beschrieben. Die heute im Labor noch gebräuchliche Herstellung aus Schwefelsäure und Kaliumnitrat geht auf Johann Rudolph Glauber (1604–1670) zurück:
Glauber entwickelte auch als erster ein Verfahren zur Darstellung von Königswasser („Aqua regis“) aus Kochsalz und Salpetersäure.
Im Jahr 1903 entwickelten der norwegische Physiker Kristian Olaf Bernhard Birkeland (1867–1917) und der norwegische Ingenieur Sam Eyde (1866–1940) ein Verfahren, bei dem sie Luftstickstoff mit Luftsauerstoff im Lichtbogen zur Reaktion brachten. Legt man zwischen zwei Elektroden in einer Reaktionskugel eine Hochspannung an, entsteht ein Lichtbogen. Dabei reagiert der Luftstickstoff mit dem Luftsauerstoff zu Stickstoffmonooxid NO. Dieses reagiert mit noch vorhandenem Sauerstoff weiter zu Stickstoffdioxid NO2, das orangebraun gefärbt ist:
Wenn das entstehende Stickstoffdioxid in Wasser geleitet wird, dann bildet sich Salpetersäure und erneut Stickstoffmonooxid:
Dieses Verfahren zur Herstellung von Salpetersäure wird selten angewandt. Es konnte sich einige Zeit lang nur in Skandinavien behaupten, also in Ländern, wo die Elektrizität durch Wasserkraft preiswert zur Verfügung steht. Heute wird Salpetersäure in der chemischen Industrie hauptsächlich nach dem Ostwald-Verfahren durch die Oxidation von Ammoniak hergestellt.
Ostwald-Verfahren zur Salpetersäureherstellung
Geschichte zur Entwicklung des Ostwald-Verfahrens
Kaliumnitrat + Schwefelsäure  Salpetersäure + Kaliumhydrogensulfat
Salpetersäure + Kaliumhydrogensulfat
KNO3 + H2SO4  HNO3 + KHSO4
HNO3 + KHSO4
Glauber entwickelte auch als erster ein Verfahren zur Darstellung von Königswasser („Aqua regis“) aus Kochsalz und Salpetersäure.
Im Jahr 1903 entwickelten der norwegische Physiker Kristian Olaf Bernhard Birkeland (1867–1917) und der norwegische Ingenieur Sam Eyde (1866–1940) ein Verfahren, bei dem sie Luftstickstoff mit Luftsauerstoff im Lichtbogen zur Reaktion brachten. Legt man zwischen zwei Elektroden in einer Reaktionskugel eine Hochspannung an, entsteht ein Lichtbogen. Dabei reagiert der Luftstickstoff mit dem Luftsauerstoff zu Stickstoffmonooxid NO. Dieses reagiert mit noch vorhandenem Sauerstoff weiter zu Stickstoffdioxid NO2, das orangebraun gefärbt ist:
N2 + O2  2 NO
2 NO
2 NO + O2  2 NO2
2 NO2
Wenn das entstehende Stickstoffdioxid in Wasser geleitet wird, dann bildet sich Salpetersäure und erneut Stickstoffmonooxid:
3 NO2 + H2O  2 HNO3 + NO
2 HNO3 + NO
Dieses Verfahren zur Herstellung von Salpetersäure wird selten angewandt. Es konnte sich einige Zeit lang nur in Skandinavien behaupten, also in Ländern, wo die Elektrizität durch Wasserkraft preiswert zur Verfügung steht. Heute wird Salpetersäure in der chemischen Industrie hauptsächlich nach dem Ostwald-Verfahren durch die Oxidation von Ammoniak hergestellt.
Ostwald-Verfahren zur Salpetersäureherstellung
Geschichte zur Entwicklung des Ostwald-Verfahrens
Salpetersäure ist ein wichtiges Zwischenprodukt zur Herstellung von Düngemitteln und anderen chemischen Verbindungen, zum Beispiel Phosphorsäure, Oxalsäure, Collodium, Amine, Farbstoffe oder Medikamente. Sie ist auch ein Ausgangsstoff zur Herstellung von Sprengstoffen wie Nitroglycerin: Beim Aufsaugen auf Kieselgur erhält man mit diesem Dynamit. Auch für die Herstellung von Trinitrotoluol (TNT) oder Hexogen (RDX) wird Salpetersäure benötigt. Kaliumnitrat, ein Salz der Salpetersäure, ist ein Bestandteil des Schwarzpulvers. Juweliere verwenden Salpetersäure in verschiedener Konzentration und Kombination mit Salzsäure als Prüfsäure zur Bestimmung des Goldgehaltes in Schmuck. Dabei überprüfen sie, ob sich ein Abrieb des Schmuckstückes in der Prüfsäure löst. Die Konzentration wird ständig erhöht, löst sich der Abrieb, dann liegt der Goldgehalt darunter.
Weitere Infos und Medien
Der Säurebegriff im Haushalt und in der Chemie, Nitrate
Filme: Platin und Gold in Salpetersäure
Herstellen der Salpetersäure im Ostwaldverfahren
Experimente zum kolloidalen Gold und Silber
Digitale Folien: Säuren, Laugen, Salze
Buch individuell erstellen: Basis-Text Salpetersäure


> Inhaltsverzeichnis
Weitere Infos und Medien
Der Säurebegriff im Haushalt und in der Chemie, Nitrate
Filme: Platin und Gold in Salpetersäure
Herstellen der Salpetersäure im Ostwaldverfahren
Experimente zum kolloidalen Gold und Silber
Digitale Folien: Säuren, Laugen, Salze
Buch individuell erstellen: Basis-Text Salpetersäure


> Inhaltsverzeichnis
© Thomas Seilnacht / Benutzerhandbuch / Lizenzbestimmungen / Impressum / Datenschutz / Literaturquellen
