Für Schülerversuche in der Sekundarstufe I wird empfohlen, höchstens die 10%ige Säure zu verwenden. Bei erfahrenen Praktikumsteilnehmern kann auch die 20%ige Lösung eingesetzt werden. Flaschen mit rauchender Salzsäure geben schon bei Raumtemperatur sehr gerne Chlorwasserstoff an die Umgebung ab. Dieses Gas wirkt toxisch beim Einatmen, es löst sich blitzartig in den Schleimhäuten, was zu schweren Reizungen und Verätzungen im Mund-, Rachen und Nasenraum führen kann. Mit rauchender, 37%iger und mit konzentrierter, 32%iger Salzsäure darf nur im Abzug gearbeitet werden. Erhitzt man verdünnte Salzsäure, muss ebenfalls im Abzug gearbeitet werden. Es wird empfohlen, rauchende Salzsäure nur im Originalgebinde oder in Flaschen mit Teflonverschluss aufzubewahren. Dafür geeignet sind auch Schraubverschlusskappen aus PBT, die mit PTFE beschichtet sind. An Schulen sollte rauchende oder konzentrierte Salzsäure nur in geeigneten Säure- und Laugenschränken mit einer kontinuierlich laufenden Ablüftung aufbewahrt werden. Bei der 10%igen oder 20%igen Salzsäure wird dagegen kaum noch Chlorwasserstoff ausgetrieben, da sich das Gas extrem gerne in Wasser löst. Bei diesen Konzentrationen reicht eine gute Raumlüftung zum Arbeiten damit aus. Die azeotrope Mischung liegt ja bei 20,17%. Schutzbrille und Schutzhandschuhe müssen getragen werden.
Gefährdungsbeurteilung Deutschland (auch EU)
GBU Arbeiten mit verdünnter Salzsäure
GBU Arbeiten mit konzentrierter Salzsäure: Springbrunnenversuch
Sicherheitsbetrachtung Schweiz
SB Arbeiten mit verdünnter Salzsäure
SB Arbeiten mit konzentrierter Salzsäure: Springbrunnenversuch
Salzsäure
HCl (aq)
CAS 7647-01-0
Salzsäure
Hydrochloric acid
Molmasse
AGW (HCl)
pKs-Wert (HCl)
Dichte (37%)
Schmelzpunkt (37%)
Siedepunkt (20,17%)
Wasserlöslichkeit
AGW (HCl)
pKs-Wert (HCl)
Dichte (37%)
Schmelzpunkt (37%)
Siedepunkt (20,17%)
Wasserlöslichkeit
36,461 g/mol (HCl)
2 ml/m3 (TRGS 900)
−6,2
1,19 g/cm3
−30 °C
+110 °C
in jedem Verhältnis mischbar
2 ml/m3 (TRGS 900)
−6,2
1,19 g/cm3
−30 °C
+110 °C
in jedem Verhältnis mischbar
Farblose, an der Luft rauchende Flüssigkeit (37%)
Teflonverschluss (über 20%)

Gefahrenklassen + Kategorie
Spez. Zielorgantox. Atemwege 3 Ätz-/Reizwirkung auf die Haut 1B Korrosiv gegenüber Metallen 1
(Abstufung bei Verdünnungen)
Spez. Zielorgantox. Atemwege 3 Ätz-/Reizwirkung auf die Haut 1B Korrosiv gegenüber Metallen 1
(Abstufung bei Verdünnungen)
HP-Sätze (siehe Hinweis)
H 314, 335, 290
P 260, 280.1–3+7, 301+330+331, 303+361+353, 305+351+338, 310
Entsorgung Vorbehandlung Säuren/Basen
H 314, 335, 290
P 260, 280.1–3+7, 301+330+331, 303+361+353, 305+351+338, 310
Entsorgung Vorbehandlung Säuren/Basen
Wirkung auf den menschlichen Körper
Die handelsübliche, 37%ige Lösung von Chlorwasserstoff in Wasser riecht stark stechend (Einatmen der Dämpfe siehe Wirkung von Chlorwasserstoff). In den Augen entstehen starke Reizungen, auch irreparable Verätzungen mit Hornhauttrübung sind möglich. Auf der Haut ruft die konzentrierte Salzsäure Rötung, Blasen und brennende Schmerzen hervor. Beim Trinken entstehen schmerzhafte Verätzungen im Rachen, Speiseröhre und Magen, was tödlich wirken kann. Bei Augenkontakt wird empfohlen, das betroffene Auge mehrere Minuten lang unter fließendem Wasser zu spülen. Danach ist das Aufsuchen eines Augenarztes notwendig. Bei Hautkontakt muss ebenfalls mit viel Wasser und später mit verdünnter Natriumcarbonat-Lösung gespült werden. Das Einnehmen von viel Wasser oder Milch verdünnt die Säure im Magen. Neutralisationsversuche mit Aktivkohle oder Laugen dürfen nicht erfolgen. Bei Erbrechen ist der Patient in Bauchlage so zu halten, dass der Kopf tief liegt, damit er nicht erstickt.
Im Magensaft kommt die Salzsäure in einer Konzentration von 0,1 bis 0,5 % vor. Die Magenwand wird durch einen alkalisch wirkenden Schleim aus der Magenschleimhaut vor der Salzsäure geschützt, die im Magen einen pH-Wert von 2 erreichen kann.
Chemische Eigenschaften
Als Salzsäure bezeichnet man die wässrige, sauer reagierende Lösung des Chlorwasserstoffs. Die gesättigte Lösung gibt Chlorwasserstoff an die Luft ab, der mit der Luftfeuchtigkeit einen Nebel bildet. Sie wird daher als „Rauchende Salzsäure“ bezeichnet.

Erhitzt man konzentrierte Salzsäure, entweicht zunächst der Chlorwasserstoff, bis man eine 20,17%ige azeotrope Mischung erhält, die bei 110 °C siedet. Diese Mischung lässt sich durch eine einfache Destillation nicht mehr trennen. Chlorwasserstoff ist eine sehr starke Säure, die wässrige Lösung ist fast vollständig zu Chlorid-Ionen Cl− und Hydronium-Ionen H3O+ dissoziiert:
Im Labor und in der Schule sind verschiedene Konzentrationen gebräuchlich. Je nach Konzentration variiert die Dichte der Lösung. Unter konzentrierter Salzsäure versteht man meistens die 32%ige Konzentration.
Hält man eine offene Flasche mit konzentrierter Ammoniaklösung an die Öffnung einer Salzsäureflasche, entsteht ein weißer Nebel. Das Ammoniakgas NH3 reagiert dabei mit dem Chlorwasserstoff HCl zu Ammoniumchlorid NH4Cl:
Eisen wird durch Salzsäure und Chlorwasserstoff leicht zum Rosten gebracht. Mit Metalloxiden reagiert Salzsäure ebenfalls. Reines Kupfer wird von Salzsäure nicht zersetzt, wohl aber Kupfer(II)-oxid. Eine Gasentwicklung ist dabei nicht zu beobachten, da statt Wasserstoff Wasser entsteht. Nach dem Eindampfen der Lösung bleibt grünes Kupfer(II)-chlorid zurück:
Legt man ein erbsengroßes Stück Natrium auf konzentrierte Salzsäure, bewegt es sich auf der Oberfläche hin und her. Dabei entsteht Wasserstoff und Natriumchlorid. Dieses ist anfangs so hoch konzentriert, dass es an den Boden des Gefäßes fällt.
Gold ist gegen Salzsäure beständig. Eine Mischung von Salzsäure und Salpetersäure wird als Königswasser bezeichnet. Dieses löst Gold auf, und es entsteht eine Lösung von Tetrachlorogold(III)-säure H[AuCl4]. Daraus können dann andere Goldverbindungen hergestellt werden.

Blattgold in konzentrierter Salpetersäure (links),
Zugabe konzentrierter Salzsäure (Mitte)

Verdünnte Salzsäure auf Calcit: Aufschäumen
Gibt man verdünnte Salzsäure auf eine Versteinerung oder auf einen Calcit, dann beginnt es kräftig zu schäumen. Mit Kalk reagiert die Salzsäure unter Kohlenstoffdioxid-Entwicklung und Bildung von Calciumchlorid und Wasser. Auf diese Art und Weise kann ein Mineraliensammler einen Calcit erkennen.
Die handelsübliche, 37%ige Lösung von Chlorwasserstoff in Wasser riecht stark stechend (Einatmen der Dämpfe siehe Wirkung von Chlorwasserstoff). In den Augen entstehen starke Reizungen, auch irreparable Verätzungen mit Hornhauttrübung sind möglich. Auf der Haut ruft die konzentrierte Salzsäure Rötung, Blasen und brennende Schmerzen hervor. Beim Trinken entstehen schmerzhafte Verätzungen im Rachen, Speiseröhre und Magen, was tödlich wirken kann. Bei Augenkontakt wird empfohlen, das betroffene Auge mehrere Minuten lang unter fließendem Wasser zu spülen. Danach ist das Aufsuchen eines Augenarztes notwendig. Bei Hautkontakt muss ebenfalls mit viel Wasser und später mit verdünnter Natriumcarbonat-Lösung gespült werden. Das Einnehmen von viel Wasser oder Milch verdünnt die Säure im Magen. Neutralisationsversuche mit Aktivkohle oder Laugen dürfen nicht erfolgen. Bei Erbrechen ist der Patient in Bauchlage so zu halten, dass der Kopf tief liegt, damit er nicht erstickt.
Im Magensaft kommt die Salzsäure in einer Konzentration von 0,1 bis 0,5 % vor. Die Magenwand wird durch einen alkalisch wirkenden Schleim aus der Magenschleimhaut vor der Salzsäure geschützt, die im Magen einen pH-Wert von 2 erreichen kann.
Chemische Eigenschaften
Als Salzsäure bezeichnet man die wässrige, sauer reagierende Lösung des Chlorwasserstoffs. Die gesättigte Lösung gibt Chlorwasserstoff an die Luft ab, der mit der Luftfeuchtigkeit einen Nebel bildet. Sie wird daher als „Rauchende Salzsäure“ bezeichnet.

Erhitzt man konzentrierte Salzsäure, entweicht zunächst der Chlorwasserstoff, bis man eine 20,17%ige azeotrope Mischung erhält, die bei 110 °C siedet. Diese Mischung lässt sich durch eine einfache Destillation nicht mehr trennen. Chlorwasserstoff ist eine sehr starke Säure, die wässrige Lösung ist fast vollständig zu Chlorid-Ionen Cl− und Hydronium-Ionen H3O+ dissoziiert:
HCl + H2O 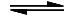 Cl− + H3O+
Cl− + H3O+
Im Labor und in der Schule sind verschiedene Konzentrationen gebräuchlich. Je nach Konzentration variiert die Dichte der Lösung. Unter konzentrierter Salzsäure versteht man meistens die 32%ige Konzentration.
| Konzentration, Massenprozent |
Konzentration, Stoffmenge | Bezeichnung | Dichte bei 20 °C |
| 37 % | 12,019 mol/l |
rauchend | 1,1844 g/cm3 |
| 32 % | 10,176 mol/l | konzentriert | 1,1594 g/cm3 |
| 20 % | 6,023 mol/l |
verdünnt | 1,0980 g/cm3 |
| 10 % | 2,873 mol/l | verdünnt | 1,0476 g/cm3 |
| 3,6 % | 1,0 mol/l | 1-molar | 1,02 g/cm3 |
| 3 % | 0,834 mol/l |
verdünnt | 1,0130 g/cm3 |
| 0,4 % | 0,1 mol/l | 0,1-molar | 1,00 g/cm3 |
Hält man eine offene Flasche mit konzentrierter Ammoniaklösung an die Öffnung einer Salzsäureflasche, entsteht ein weißer Nebel. Das Ammoniakgas NH3 reagiert dabei mit dem Chlorwasserstoff HCl zu Ammoniumchlorid NH4Cl:
NH3 +
HCl  NH4+
+ Cl−
NH4+
+ Cl−
Schon die verdünnte Säure reagiert gerne mit unedlen Metallen unter Bildung von Wasserstoff und Metallsalzen. Dabei entstehen die Chloride, die Salze der Salzsäure. Mit Magnesium erhält man Magnesiumchlorid, mit Zink Zinkchlorid:
2 HCl (aq) + Mg  MgCl2 + H2
MgCl2 + H2
2 HCl (aq) + Zn ZnCl2 + H2
ZnCl2 + H2
2 HCl (aq) + Zn
Eisen wird durch Salzsäure und Chlorwasserstoff leicht zum Rosten gebracht. Mit Metalloxiden reagiert Salzsäure ebenfalls. Reines Kupfer wird von Salzsäure nicht zersetzt, wohl aber Kupfer(II)-oxid. Eine Gasentwicklung ist dabei nicht zu beobachten, da statt Wasserstoff Wasser entsteht. Nach dem Eindampfen der Lösung bleibt grünes Kupfer(II)-chlorid zurück:
CuO + 2 HCl (aq)  CuCl2 + H2O
CuCl2 + H2O
Legt man ein erbsengroßes Stück Natrium auf konzentrierte Salzsäure, bewegt es sich auf der Oberfläche hin und her. Dabei entsteht Wasserstoff und Natriumchlorid. Dieses ist anfangs so hoch konzentriert, dass es an den Boden des Gefäßes fällt.
2 Na + 2 HCl (aq)  2 NaCl + H2
2 NaCl + H2
Gold ist gegen Salzsäure beständig. Eine Mischung von Salzsäure und Salpetersäure wird als Königswasser bezeichnet. Dieses löst Gold auf, und es entsteht eine Lösung von Tetrachlorogold(III)-säure H[AuCl4]. Daraus können dann andere Goldverbindungen hergestellt werden.
Blattgold in konzentrierter Salpetersäure (links),
Zugabe konzentrierter Salzsäure (Mitte)
Verdünnte Salzsäure auf Calcit: Aufschäumen
Gibt man verdünnte Salzsäure auf eine Versteinerung oder auf einen Calcit, dann beginnt es kräftig zu schäumen. Mit Kalk reagiert die Salzsäure unter Kohlenstoffdioxid-Entwicklung und Bildung von Calciumchlorid und Wasser. Auf diese Art und Weise kann ein Mineraliensammler einen Calcit erkennen.
CaCO3 + 2 HCl (aq)  CaCl2 + CO2 + H2O
CaCl2 + CO2 + H2O
Im Gegensatz zur Schwefelsäure und Salpetersäure wurde die Salzsäure relativ spät entdeckt. Die Herstellung einer salzsäureähnlichen Substanz wurde in dem Werk Alchemia von Andreas Libavius (geboren um 1540) durch das Glühen von Kochsalz und Ton beschrieben. Basilius Valentinus beschrieb nur wenig später die Umsetzung von „Vitriol“ (Kupfersulfat) mit Kochsalz, bei der „ätzendes Wasser“ („aqua caustica“) entstand. Johann Rudolph Glauber (1604–1670) entwickelte ein eigenes Verfahren: Er tränkte glühende Holzkohle mit einer Kochsalzlösung und verbrannte diese in einem Ofen. Das Verfahren von Valentinus erweiterte er, in dem er eine Mischung aus Vitriol und Alaun auf die glühenden Kohlen gab. Auf diese Art und Weise konnte Glauber eine konzentriertere Salzsäure („Spiritus salis“) darstellen als die Vorgänger. Eine der größten Entdeckungen Glaubers war jedoch die Herstellungsmethode aus Kochsalz und Schwefelsäure. Dieses Verfahren wird heute noch im Labor angewandt:
Glauber war damit der erste, der gasförmigen Chlorwasserstoff herstellte. Dabei konnte er neben einer relativ konzentrierten Salzsäure („Salzgeist“, vermutlich bis zu 26%) auch das nach ihm benannte Natriumsulfat („sal mirabile Glauberi“) gewinnen. Beim Lösen von Metallen in der Säure stellte er auch erstmals die Metallchloride dar („solvirte Metalle“). Im heutigen Labor kann man Chlorwasserstoff direkt durch die Reaktion von Chlor mit Wasserstoff herstellen. Diese Reaktion kann, vor allem unter Lichteinwirkung, explosionsartig erfolgen:
Der Chlorwasserstoff wird dann in Wasser gelöst. Dabei wirkt der Chlorwasserstoff als Säure und gibt ein Proton an das Wassermolekül ab. Wie gut sich der Chlorwasserstoff im Wasser löst, wird im Unterricht oft beim „Springbrunnenversuch“ gezeigt: Füllt man einen trockenen Rundkolben mit Chlorwasserstoff und versieht diesen mit einer nach innen zeigenden Düse, dann wird sofort Wasser aus einer Schale angezogen, sobald man die rückseitige Öffnung der Düse in das Wasser hält. Eine im Wasser gelöste Universalindikator-Lösung färbt sich dabei rot.
Die OH-Bindung im gebildeten Hydronium-Ion (auch Oxonium-Ion, H3O+) ist polarer als im Wassermolekül, damit ist sie energieärmer. Bei der Hydratation der entstehenden Ionen wird Energie freigesetzt. Daher ist das Lösen von Chlorwasserstoff in Wasser ein exothermer Vorgang. Experimentell kann man das zeigen, wenn man einen mit Wasser angefeuchteten Wattebausch an einem Thermometerfühler in einen mit Chlorwasserstoff gefüllten Behälter hält. Die Temperatur steigt deutlich an.

 Hängt man einen angefeuchteten Wattebausch an einem Thermometerfühler
Hängt man einen angefeuchteten Wattebausch an einem Thermometerfühler
in einen Behälter mit Chlorwasserstoff, steigt die Temperatur deutlich an.
In der chemischen Industrie gewinnt man die Salzsäure bei Chlorierungs-Prozessen der organischen Chemie, wo Chlorwasserstoff zum Beispiel bei der Herstellung von Vinylchlorid aus Ethen als Nebenprodukt anfällt:
Vinylchlorid ist ein wichtiges Zwischenprodukt zur Herstellung des Kunststoffes PVC. Im ersten Schritt wird das Ethen durch eine elektrophile Addition mit Chlor zu Dichlorethan chloriert. Im zweiten Schritt wird Chlor mit Hilfe eines Aluminiumoxid-Katalysators eliminiert. Den Chlorwasserstoff lässt man in Türmen herabrieselndem Wasser entgegenströmen, wobei die Salzsäure entsteht.
Natriumchlorid + Schwefelsäure  Chlorwasserstoff + Natriumhydrogensulfat
Chlorwasserstoff + Natriumhydrogensulfat
NaCl + H2SO4 HCl + NaHSO4
HCl + NaHSO4
NaCl + H2SO4
Glauber war damit der erste, der gasförmigen Chlorwasserstoff herstellte. Dabei konnte er neben einer relativ konzentrierten Salzsäure („Salzgeist“, vermutlich bis zu 26%) auch das nach ihm benannte Natriumsulfat („sal mirabile Glauberi“) gewinnen. Beim Lösen von Metallen in der Säure stellte er auch erstmals die Metallchloride dar („solvirte Metalle“). Im heutigen Labor kann man Chlorwasserstoff direkt durch die Reaktion von Chlor mit Wasserstoff herstellen. Diese Reaktion kann, vor allem unter Lichteinwirkung, explosionsartig erfolgen:
Wasserstoff + Chlor  Chlorwasserstoff
Chlorwasserstoff
H2 + Cl2 2 HCl
2 HCl
H2 + Cl2
Der Chlorwasserstoff wird dann in Wasser gelöst. Dabei wirkt der Chlorwasserstoff als Säure und gibt ein Proton an das Wassermolekül ab. Wie gut sich der Chlorwasserstoff im Wasser löst, wird im Unterricht oft beim „Springbrunnenversuch“ gezeigt: Füllt man einen trockenen Rundkolben mit Chlorwasserstoff und versieht diesen mit einer nach innen zeigenden Düse, dann wird sofort Wasser aus einer Schale angezogen, sobald man die rückseitige Öffnung der Düse in das Wasser hält. Eine im Wasser gelöste Universalindikator-Lösung färbt sich dabei rot.
Die OH-Bindung im gebildeten Hydronium-Ion (auch Oxonium-Ion, H3O+) ist polarer als im Wassermolekül, damit ist sie energieärmer. Bei der Hydratation der entstehenden Ionen wird Energie freigesetzt. Daher ist das Lösen von Chlorwasserstoff in Wasser ein exothermer Vorgang. Experimentell kann man das zeigen, wenn man einen mit Wasser angefeuchteten Wattebausch an einem Thermometerfühler in einen mit Chlorwasserstoff gefüllten Behälter hält. Die Temperatur steigt deutlich an.

in einen Behälter mit Chlorwasserstoff, steigt die Temperatur deutlich an.
In der chemischen Industrie gewinnt man die Salzsäure bei Chlorierungs-Prozessen der organischen Chemie, wo Chlorwasserstoff zum Beispiel bei der Herstellung von Vinylchlorid aus Ethen als Nebenprodukt anfällt:
Ethen + Chlor  Dichlorethan
Dichlorethan  Vinylchlorid + Chlorwasserstoff
Vinylchlorid + Chlorwasserstoff
H2C=CH2 + Cl2 ClH2C-CH2Cl
ClH2C-CH2Cl  H2C=CHCl + HCl
H2C=CHCl + HCl
H2C=CH2 + Cl2
Vinylchlorid ist ein wichtiges Zwischenprodukt zur Herstellung des Kunststoffes PVC. Im ersten Schritt wird das Ethen durch eine elektrophile Addition mit Chlor zu Dichlorethan chloriert. Im zweiten Schritt wird Chlor mit Hilfe eines Aluminiumoxid-Katalysators eliminiert. Den Chlorwasserstoff lässt man in Türmen herabrieselndem Wasser entgegenströmen, wobei die Salzsäure entsteht.
Im Schullabor ist Salzsäure ein wichtiger Stoff für zahlreiche Versuche, zum Beispiel für den Springbrunnenversuch, für Titrationen und Neutralisationsversuche, für die Herstellung von Salzen aus Metallen oder Metalloxiden, als Reagenz bei chemischen Analysen zum Auflösen von Proben und für viele weitere Grundversuche. Im Haushalt und Garten dient Salzsäure zum Reinigen von Kalkrückständen an Fliesen oder zum Entfernen von Mörtelresten an Mauern.
In der chemischen Industrie ist Salzsäure ein bedeutendes Zwischenprodukt zur Herstellung zahlreicher Stoffe. So kann man aus Salzsäure Chloride wie Aluminiumchlorid oder Eisen(III)-chlorid zur Wasseraufbereitung herstellen. Für die Synthese organischer Chlorverbindungen wie PVC wird hauptsächlich Chlorwasserstoff eingesetzt. In der Pharmazie lassen sich mit Salzsäure wasserunlösliche Wirkstoffe in wasserlösliche Hydrochloride überführen. Beim Aufbereiten von Erzen werden Metallverbindungen mit Hilfe der Salzsäure herausgelöst. Bei der Metallverarbeitung wird sie beim Beizen von Stahl zur Rostentfernung genutzt und sie wird zum Ätzen, Löten oder Galvanisieren benötigt. Bei der Holzverzuckerung wird Cellulose beim Kochen mit konzentrierter Salzsäure in einer Hydrolyse zu einem Zucker umgewandelt. Dieses Verfahren ist bedeutend zur Gewinnung von Glucose.
Weitere Infos und Medien
Chlorwasserstoff im Chemikalienlexikon
Der Säurebegriff im Haushalt und in der Chemie, Chloride
Demonstrationen zur Ätzwirkung der Stoffe
Schülerübung: Exotherme und endotherme Reaktionen (Salzsäure und Natronlauge)
Schülerübung: Reaktionsgeschwindigkeit (Salzsäure mit Zink)
Arbeitsheft: Säuren, Laugen, Salze (für die Klassenstufen 8 oder 9)
Filme: Metalle reagieren mit Salzsäure
Digitale Folien: Säuren, Laugen, Salze
Buch individuell erstellen: Basis-Text Chlorwasserstoff und Salzsäure


> Inhaltsverzeichnis
In der chemischen Industrie ist Salzsäure ein bedeutendes Zwischenprodukt zur Herstellung zahlreicher Stoffe. So kann man aus Salzsäure Chloride wie Aluminiumchlorid oder Eisen(III)-chlorid zur Wasseraufbereitung herstellen. Für die Synthese organischer Chlorverbindungen wie PVC wird hauptsächlich Chlorwasserstoff eingesetzt. In der Pharmazie lassen sich mit Salzsäure wasserunlösliche Wirkstoffe in wasserlösliche Hydrochloride überführen. Beim Aufbereiten von Erzen werden Metallverbindungen mit Hilfe der Salzsäure herausgelöst. Bei der Metallverarbeitung wird sie beim Beizen von Stahl zur Rostentfernung genutzt und sie wird zum Ätzen, Löten oder Galvanisieren benötigt. Bei der Holzverzuckerung wird Cellulose beim Kochen mit konzentrierter Salzsäure in einer Hydrolyse zu einem Zucker umgewandelt. Dieses Verfahren ist bedeutend zur Gewinnung von Glucose.
Weitere Infos und Medien
Chlorwasserstoff im Chemikalienlexikon
Der Säurebegriff im Haushalt und in der Chemie, Chloride
Demonstrationen zur Ätzwirkung der Stoffe
Schülerübung: Exotherme und endotherme Reaktionen (Salzsäure und Natronlauge)
Schülerübung: Reaktionsgeschwindigkeit (Salzsäure mit Zink)
Arbeitsheft: Säuren, Laugen, Salze (für die Klassenstufen 8 oder 9)
Filme: Metalle reagieren mit Salzsäure
Digitale Folien: Säuren, Laugen, Salze
Buch individuell erstellen: Basis-Text Chlorwasserstoff und Salzsäure


> Inhaltsverzeichnis
© Thomas Seilnacht / Benutzerhandbuch / Lizenzbestimmungen / Impressum / Datenschutz / Literaturquellen