| Schwefel 16S | |||
| engl. Sulfur; sanskrit sweb oder sweblan („schlafen“ oder „erschlagen“) | |||
|
|||
|
Reiner Schwefel ist bei Zimmertemperatur ein Nichtmetall mit zitronengelber
Farbe und leicht die Atemwege reizenden, charakteristischem Geruch. Die Wärmeleitfähigkeit und auch die elektrische Leitfähigkeit ist schlecht. Schwefel ist in Wasser nicht löslich. Kompakte
Schwefelkristalle gehen aufgrund der höheren Dichte im Wasser
unter. Gepulverter Schwefel kann aufgrund der fehlenden
Benetzungsfähigkeit mit Wasser und mit Hilfe der
Oberflächenspannung des Wassers auch schwimmen. Löst
man Schwefel in Schwefelkohlenstoff, und lässt man die Lösung
in einer Petrischale längere Zeit stehen, kristallisieren nach einiger
Zeit rhombische Schwefelkristalle aus. Beim Abkühlen einer Schwefelschmelze an der Luft bilden sich dagegen monokline Kristalle. Beim Abschrecken
einer Schwefelschmelze in kaltem Wasser entsteht plastischer Schwefel.
Schwefel tritt in zahlreichen Modifikationen auf,
von denen hier nur eine Auswahl behandelt wird. Orthorhombischer oder
rhombischer Schwefel ist bei Raumtemperatur stabil und bildet
zitronengelbe Kristalle,
die leicht zerbrechen und zu einem feinen Pulver vermahlen werden
können. Die im Handel erhältlichen Stangen oder Fäden
enthalten rhombischen Schwefel.
Rhombischer Schwefel wird auch α-Schwefel genannt, atomar ist er aus ringförmig gewellten S8-Molekülen aufgebaut. Er geht beim Erwärmen ab 95,2 °C in eine gelbe,
leichtflüssige Schmelze über und man erhält λ-Schwefel.
Erwärmt man weiter, färbt sich die Schmelze orange,
sie wird ab 159 °C allmählich dickflüssig
und bildet bei 200 °C eine dunkelbraune und
harzartige Masse, den μ-Schwefel.
Dabei lösen sich die ringförmigen S8-Moleküle auf und bilden lange Ketten. Oberhalb von 250°C nimmt die Zähflüssigkeit ab, und beim Siedepunkt, bei 444 °C, ist die Schmelze wieder dünnflüssig. Lässt man den geschmolzenen Schwefel in großen Tiegeln an der Oberfläche erstarren, bilden sich lange, monokline Kristallnadeln. Diese Modifikation wird als monokliner Schwefel oder als β-Schwefel bezeichnet. Beim Abkühlen auf unter 115,2 °C wandelt sich
dieser wieder langsam in rhombischen Schwefel um. Gießt
man die dünnflüssige Schmelze in ein Glas mit kaltem
Wasser,
bilden sich elastische Fäden oder eine gelbbraune,
zähe Masse, die als plastischer Schwefel bezeichnet wird. Auch dieser wandelt sich allmählich wieder
in den rhombischen Schwefel zurück.
Schwefel
ist sehr reaktionsfähig und geht mit vielen Elementen chemische Verbindungen
ein. Die Ausnahme bilden Gold, Platin, Iridium, Stickstoff, Tellur, Iod
und die Edelgase. An der Luft verbrennt Schwefel in einer Oxidation mit bläulicher Flamme zu dem toxischen und stechend riechenden Gas Schwefeldioxid SO2,
das auch mit Schwefeltrioxid SO3 vermischt sein
kann:
S + O2
Beim Lösen des Schwefeldioxids in Wasser entstehen eine Schwefeldioxid-Lösung und in geringen Mengen auch Schweflige
Säure. Die Salze dieser Säure sind die Sulfite. Entzündet
man Gemische aus Schwefel- und Metallpulver, entstehen meist unter starker
Wärmeentwicklung und Aufleuchten die entsprechenden Metallsulfide:
Fe + S Zn + S Cu + S
Mit Methan und einem Aluminiumoxid-Katalysator erhält man bei 700 °C Schwefelkohlenstoff,
eine giftige, farblose Flüssigkeit:
CH4 + 4 S Durch die Reaktion von
Schwefel und Wasserstoff bei 350 °C
mit Hilfe von Katalysatoren gewinnt man das giftige Gas Schwefelwasserstoff:
S + H2 Von Salzsäure wird
Schwefel nicht angegriffen, dagegen aber von oxidierend wirkenden Säuren
wie konzentrierte Salpetersäure.
Weitere wichtige Verbindungen des Schwefels sind die Schwefelsäure, sowie ihre Salze, die Sulfate. Ist bei den Alkoholen
das Sauerstoff-Atom der Hydroxy-Gruppe durch ein Schwefel-Atom ersetzt, dann
erhält man ein Thiol (veraltet: Mercaptan oder Thioalkohol). Diese Stoffgruppe zeichnet sich durch einen sehr unangenehmen Geruch aus. |
Pflanzen
nehmen das Bioelement Schwefel in Form der Sulfate
über die Wurzeln auf. Bei der Reduktion in den Chloroplasten wird
das Sulfat zu den Aminosäuren Cystein und Methionin assimiliert. Schwefel
ist auch ein Bioelement im menschlichen Körper.
Beim Cystin sind zwei Cystein-Moleküle über eine Sulfidgruppe
chemisch verbunden. Die Thiolgruppe R-S-H ist in vielen Peptiden, Proteinen
oder Koenzymen enthalten. Beim Biotin-Molekül (Vitamin H) oder beim
Thiaminpyrophosphat-Molekül (Vitamin B1) sind ebenfalls Schwefel-Atome
integriert.
Die akute Toxizität
des elementaren Schwefels wird als nicht besonders hoch eingestuft. Allerdings
kann sublimierter Schwefel auf der Haut und vor allem in den Augen Reizungen
auslösen. Beim Verbrennen entsteht das stark giftige Gas Schwefeldioxid. |
|
Häufigkeit relativ häufig
Das Element Schwefel macht in der Erdhülle einen Anteil von etwa 0,05 Massenprozent aus. In der Natur kommt der Schwefel elementar in mächtigen Lagerstätten, beispielsweise in Sizilien, Polen, Irak, Louisiana, Texas und Mexiko vor. Bei den vulkanischen Solfataren lagert sich Schwefel ab. Dort tritt erhitztes und verdampftes Grundwasser zu Tage, das mit den Gasen des Magmas wie Schwefelwasserstoff gesättigt ist. In Europa findet man die Solfatare zum Beispiel auf Island oder bei den Vulkanen in Italien. Wichtige Minerale, die Schwefelverbindungen enthalten, sind Gips (Calciumsulfat), Pyrit und Markasit (Eisensulfid), Buntkupferkies (Kupfersulfid), Bleiglanz (Bleisulfid), Zinkblende (Zinksulfid) oder Zinnober (Quecksilbersulfid). Größere Mengen Schwefel sind auch in den fossilen Brennstoffen Erdöl und Kohle enthalten. Erdgas ist oft mit Schwefelwasserstoff verunreinigt. Die Hauptproduzenten für Schwefel sind China, die USA, Russland, Saudi-Arabien, die Vereinigten Arabischen Emirate, Kanada, Kasachstan, Indien, Südkorea, Japan, Iran und Katar.
|
Der deutsche Name Schwefel geht wahrscheinlich auf sanskrit swep oder sweblan („schlafen“ oder „erschlagen“) zurück. Er hat vermutlich seinen Ursprung in der
Giftigkeit des Verbrennungsproduktes, des Gases Schwefeldioxid. Das
Symbol S, als Abkürzung für das lateinische Wort sulphur,
schlug der schwedische Chemiker J.J. Berzelius 1814 vor.
Schwefel ist seit der Antike und wahrscheinlich auch schon seit dem Altertum bekannt. In der Bibel wird im Buch Genesis erzählt, wie die Städte Sodom und Gomorra in einem himmlischen Regen aus Feuer und Schwefel zerstört und der Boden dauerhaft unfruchtbar gemacht werden. Auch an anderen Stellen in der Bibel kommt das Motiv eines apokalyptischen Strafgerichts mit Leid und Zerstörung in Verbindung mit dem Schwefel vor. Im Altertum dienten Schwefel und Schwefeldioxid als Desinfektionsmittel bei Infektionskrankheiten und als Konservierungsmittel für Wein. Im altägyptischen Papyrus Ebers, das im 16. Jahrhundert vor Christus geschrieben wurde, wird die Behandlung der Ägyptischen Augenkrankheit mit Schwefel beschrieben. Diese bakterielle Augenentzündung wird heute Trachom genannt und durch das Bakterium Chlamydia trachomatis ausgelöst. Im griechischen Homer-Epos lässt Odysseus Schwefel bringen, um einen Saal mit den ermordeten Freiern darin vom Fluch zu reinigen. Aristoteles erwähnt den Schwefel ebenfalls und beschreibt ihn als göttlich. Im alten China konnte der Schwefel bereits im 6. Jahrhundert vor Christus aus natürlichen Quellen gewonnen werden. Ab dem 3. Jahrhundert vor Christus war in China die Herstellung aus Pyrit möglich. [Lit. 12, 138, 142, 143]
Schon vor der Römerzeit waren die schwefelhaltigen Quellen im Jordantal bekannt. Der Talmud erwähnt diese natürlichen Heilbäder bei der Stadt Tiberias am See Genezareth. Plinius beschreibt Schwefelvorkommen in Sizilien und auf der Insel Milos in der Ägäis. Der Schwefeldampf diente bei den Römern zum Bleichen von Textilien. Schwefel wurde auch für medizinische Zwecke und zur Herstellung von Streichhölzern und Lampendochten benötigt. In China war die Herstellung des Schwarzpulvers schon im 11. Jahrhundert zur Zeit der Song-Dynastie bekannt. Im 13. Jahrhundert beschrieb Roger Bacon dessen Herstellung aus Kaliumnitrat, Holzkohlepulver und Schwefel. Der Alchimist hatte das Rezept vermutlich von chinesischen Mönchen erhalten. In der Antike war das Schwarzpulver nicht bekannt. Das als Brandwaffe verwendete griechische Feuer soll jedoch Schwefel enthalten haben. Dschabir ibn Hayyan (auch „Geber arabicus“ genannt, 725–812 n.Chr.) befasste sich ausführlich mit dem Schwefel und den damals bekannten sulfidischen Verbindungen. Der Schwefel galt für ihn als das Prinzip der Brennbarkeit. Der Begriff sulphur wurde daher von den Alchemisten häufig für alle entsprechenden Stoffe verwendet. Zu jener Zeit kam auch die Mercurius-Sulphur-Theorie auf, die das Entstehen der Metalle in der Erde erklären sollte.
Die erstmalige Darstellung der Schwefelsäure, die bei den Alchemisten unter dem Namen oleum vitrioli bekannt war, geht eventuell bis auf Geber oder auch auf den persischen Arzt Muhammad bin Zakarya (auch „Rhazes“ genannt, 865–925) zurück. Beim Erhitzen von Vitriolen, also von Eisensulfat oder Kupfersulfat, erhielten die Alchemisten als Endprodukt das Vitriolöl. Das Aufheizen erfolgte in Retorten unter Luftabschluss in einem Galeerenofen, das entstehende Schwefeltrioxid konnte mit Wasser in einem Auffangbehälter zum Vitriolöl umgesetzt werden. Das Vitriolverfahren wurde von verschiedenen Alchemisten beschrieben, zum Beispiel auch durch Andreas Libavius in seinem 1597 erschienenen Werk Alchemia.
Georg Ernst Stahl (1660–1734) war noch ein Vertreter der Phlogistontheorie. Er glaubte, dass im Schwefel Schwefelsäure und ein Phlogiston enthalten sei, das bei der Verbrennung entweicht. Die alchemistischen Symbole für Schwefel verwenden daher oft ein Kreuz, auf dem ein Dreieck mit der Spitze nach oben sitzt. Das Kreuz steht für die ätzende Kraft der Schwefelsäure und das Dreieck oder ein Pfeil für das Feuer mit dem entweichenden Phlogiston. [Lit. 12] 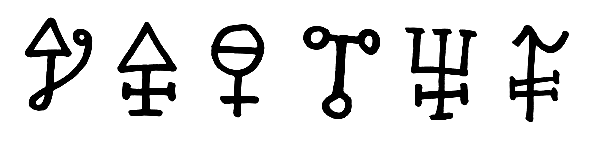 Alchemistische Symbole für Schwefel: Kreuz (Schwefelsäure) und Dreieck oder Pfeil (Phlogiston) Ab 1777 vermutete Antoine Lavoisier (1743–1794) den elementaren Charakter des Schwefels. Mit seinen Experimenten zur Verbrennung von Schwefel und Phosphor legte er die Grundlage für den Sturz der Phlogistontheorie. Den endgültigen Beweis für den Elementcharakter des Schwefels erbrachten Joseph Gay-Lussac (1778–1850) und Louis Jacques Thénard (1777–1857) im Jahr 1809.
Mit der Erfindung des Bleikammerverfahrens durch Roebuck und Garbett in Birmingham konnte man die Schwefelsäure ab dem Jahr 1774 industriell produzieren. Ein Gemisch aus Schwefeldioxid, Luft und Stickoxiden wurde in einem mit Schamottziegeln ausgekleideten Reaktionsturm auf etwa 400 °C erhitzt. Das entstehende Gasgemisch kam dann in mehrere mit Blei ausgekleidete, hintereinandergeschaltete Behälter, wo es mit Wasser berieselt wurde und dabei zur einer 60 bis 70%igen Schwefelsäure reagierte. Man verwendete eine Bleiauskleidung, da dies zu jener Zeit das einzige billige Metall war, das von konzentrierter Schwefelsäure nicht angegriffen wird. In der Folgezeit wurde das Bleikammerverfahren verbessert. Das heute angewandte Kontaktverfahren zur Gewinnung von Schwefelsäure wurde durch die deutschen Chemiker Clemens Winkler (1838–1904) und Rudolf Knietsch (1854–1906) entwickelt. Als Ausgangsprodukt wird flüssiger Schwefel eingesetzt, der aus der Aufbereitung von Erdgas stammt.
Der aus Deutschland stammende US-Chemiker Hermann Frasch (1851–1914) entwickelte um 1890 das nach ihm benannte Frasch-Verfahren, mit dem der Schwefel aus tief liegenden Lagerstätten ohne bergmännischen Abbau kontinuierlich gefördert werden kann. |
Etwa
die Hälfte des benötigten Schwefels kann aus gediegenem Schwefel
und einer nachfolgenden Reinigung durch Destillation gewonnen werden. Durch
ein bis zu 800 Meter langes Rohr wird heißes Wasser unter Druck in das
schwefelhaltige Gestein hineingedrückt. Der unterirdische Schwefel
schmilzt und wird anschließend mit heißer Pressluft nach oben
befördert. Man erhält Schwefel mit 99,5 bis 99,8 % Reinheit. Ein Bohrloch kann bis zu 300 Tonnen Schwefel pro Tag fördern.
Einen weiteren großen Anteil erhält man bei der Entschwefelung von Erdöl und Erdgas nach dem Claus-Verfahren. In zwei Stufen wird der im Erdgas oder in Kokerei-Gasen enthaltene Schwefelwasserstoff H2S zunächst zu etwa einem Drittel mit Sauerstoff in einer Brennkammer zu Schwefeldioxid verbrannt. Dieses wird dann zusammen mit den restlichen zwei Dritteln Schwefelwasserstoff in Gegenwart eines Bauxitkatalysators bei etwa 300 °C umgesetzt:
1. Schritt:
2 H2S + 3 O2
2. Schritt: 2 SO2 + 4 H2S Gesamtreaktion: 6 H2S + 3 O2 Auch durch das Rösten von Pyrit kann Schwefel gewonnen werden. Man erhält beim Erhitzen
des Erzes Schwefeldioxid, das anschließend mit Kohlenstoff oder Koks
reduziert wird. |
Schwefel
ist ein wichtiger Rohstoff in der chemischen Industrie. Der größte
Anteil dient zur Herstellung von Schwefelsäure und damit auch zur Herstellung von Düngemitteln.
Aus der Schwefelsäure sind zahlreiche Schwefelverbindungen zugänglich,
so auch die Sulfate. Reiner Schwefel wird zur
Herstellung von Zündhölzern, Schwarzpulver, Feuerwerkskörper,
zur Herstellung von Kunststoffen, Farbstoffen und Pigmenten (Ultramarinblau),
zur Vulkanisation von Kautschuk und Gummi, zum Schwefeln von Fässern
oder als Bleichmittel für Wolle und Seide verwendet. In der Medizin
findet er in Salben und Cremes zur Bekämpfung von Hautkrankheiten
wie Akne, Ekzeme, Krätze oder Schuppenflechte Anwendung. Schwefelbäder
sollen gegen Rheuma und Gicht wirken. Im Wein- und Gartenbau dient Schwefel zur
Bekämpfung von Spinnmilben und Mehltau.
|
| Demonstrationen
mit Schwefel Sulfidreaktionen Digitale Folien zum Schwefel |
|
|