Vorkommen und Bedeutung im menschlichen Körper
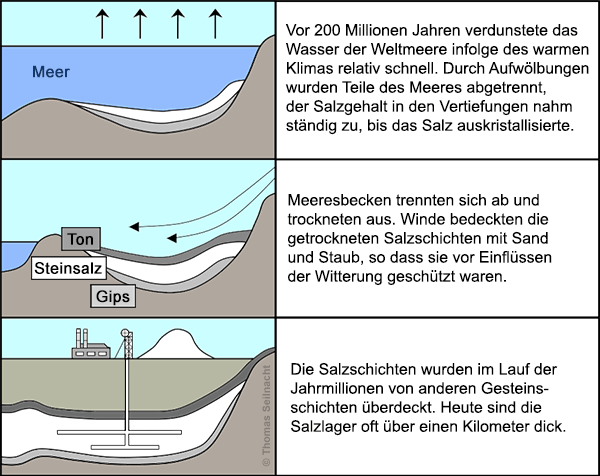
Natriumchlorid ist in der Natur ein verbreiteter Stoff. Meerwasser enthält bis zu drei Prozent. Das Steinsalz in den Lagerstätten ist bei den Mineralogen unter dem Namen
Halit bekannt. Insgesamt finden sich im Körper jedes Menschen etwa 200 Gramm Natriumchlorid. Kochsalz gehört zu den lebensnotwendigen Mineralstoffen, der Mensch muss pro Tag zwei bis fünf Gramm zu sich nehmen. Die Natrium-Ionen ermöglichen in den Nervenzellen die Erregungsleitung, die Chlorid-Ionen sind am Aufbau der Magensäure, welche zu 0,3 Prozent aus Salzsäure besteht, beteiligt.
Chemisch-physikalische Eigenschaften
Reines Natriumchlorid bildet farblose Kristalle, die in gemahlener Form oder als kristallines Pulver weiß erscheinen. Das Natrium-Salz der
Salzsäure besitzt den typischen Salzgeschmack und wird zusammen mit Zusätzen wie Kaliumiodat oder Natriumiodat als „Kochsalz“ oder „Speisesalz“ in vielen Lebensmitteln zum Würzen verwendet. Das Salz ist kaum hygroskopisch und kann gut an der Luft gelagert werden. Unterhalb 0,15 °C bildet sich ein Dihydrat NaCl • 2 H
2O.

Salzlager in einer Saline.
Natriumchlorid setzt den Schmelzpunkt von Wasser herab, wenn es mit diesem vermischt wird. Auf dieser Eigenschaft beruht seine Verwendung als Streusalz und in Kältemischungen. Natriumchlorid ist gut in Wasser löslich, in Ethanol und Aceton dagegen weniger. Die Wasserlöslichkeit nimmt beim Erwärmen im Vergleich zu anderen Salzen wie
Kaliumnitrat nur wenig zu:
Wasserlöslichkeit (L): 100g H2O lösen x g Natriumchlorid wasserfrei
0 °C
|
20 °C
|
40 °C
|
60 °C
|
80 °C
|
100 °C |
35,6 g
|
35,8 g
|
36,42 g
|
37,05 g
|
38,05 g
|
39,2 g |
Beim natürlich vorkommenden
Steinsalz wird die Würfelform gegenüber der Oktaederform bevorzugt. Beim schnellen Auskristallisieren der konzentrierten Natriumchlorid-Lösung auf dem Objektträger kann man unter dem Mikroskop neben den Würfeln auch Oktaeder beobachten:

Natriumchlorid-Kristalle unter dem Mikroskop.
Natriumchlorid kristallisiert nach dem
kubischen System. Im Gegensatz zum
Caesiumchlorid sind die Kristalle nach der
Natriumchlorid-Struktur aufgebaut: Im
Ionengitter ist jedes Na
+-Ion von sechs Cl
−-Ionen umgeben und umgekehrt ebenso.
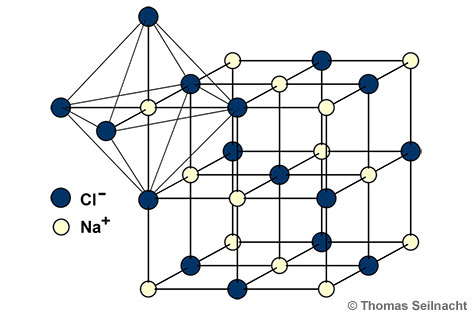
Natriumchlorid-Struktur.
Reines, kristallines Natriumchlorid ist kein Leiter für elektrischen Strom. Die wässrige Lösung und die Schmelze leiten den elektrischen Strom dagegen sehr gut, weil Ionen vorliegen.
Oft ist das Salz in unterirdischen Steinsalzlagern abgelagert, die sich aus ehemaligen Meeren gebildet haben. Früher kam man schwer an die Salzlager heran, heute werden sie industriell abgebaut. Die Salzlager können bergmännisch abgebaut werden, oder man pumpt Wasser in die Lagerstätten hinein und fördert die gebildete Sole.
In der chemischen Industrie kommen vier verschiedene Verfahren zur Gewinnung zum Einsatz:
1.) Bei der Siedesalzgewinnung werden unterirdische Steinsalzschichten mit Wasser ausgelaugt. Durch Verdampfen der gewonnenen Sole gewinnt man das reine Salz.
2.) In Bergwerken wird Steinsalz bergmännisch abgebaut.
3.) In Salinen lässt man Meerwasser verdampfen und erhält so das getrocknete Salz.
4.) Bei der Meerwasserentsalzung fällt Natriumchlorid als Nebenprodukt an.

In dieser Saline auf Lanzarote verdampft das Meerwasser, das Salz bleibt zurück.
Im Labor lässt sich Natriumchlorid durch die
Reaktion von Natrium mit Chlor herstellen. Dieses Verfahren ist zur industriellen Gewinnung zu teuer. Bei der Reaktion entsteht ein weißer Stoff, den man mit Hilfe von
Silbernitrat und der
Flammprobe als Natriumchlorid identifizieren kann.
2 Na +
Cl
2 
2
NaCl
DHR = −822 kJ/molKochsalz ist neben der
Essigsäure das älteste Mittel, um Lebensmittel haltbar zu machen. Schon im Altertum kannten die Sumerer und Babylonier Salzfleisch und Salzfisch als Handelsartikel. Im 14. Jahrhundert wurde das „weiße Gold“ zu hohen Preisen gehandelt, es war zeitweise so teuer wie Gold. Erst mit der Entdeckung großer Salzlager in Mittel- und Süddeutschland wurde es auch für ärmere Leute erschwinglich.
Früher besaß die Schweiz außer einer kleinen Anlage in Bex keine eigene Salzversorgung. Noch im 18. Jahrhundert belieferte Bad Reichenhall fast die gesamte Ost- und Zentralschweiz mit Salz. Die ersten Bohrversuche in der Nordwestschweiz fanden im Jahr 1836 bei Muttenz in Schweizerhalle statt. Bereits ein Jahr später wurde die erste Saline am Rhein bei Basel in Betrieb genommen.
Kochsalz wird heute den Lebensmitteln nicht nur als Würzmittel, sondern auch zur Konservierung zugesetzt. Das Salz bindet in den Lebensmitteln Wasser und entzieht den Bakterien und Schimmelpilzen so ihre Nahrungsgrundlage. Viele Käse-, Fleisch- oder Fischsorten werden mit Salz versetzt oder vor ihrer Weiterverarbeitung in ein Salzbad getaucht.

Angebot verschiedener Salzprodukte
Iodiertes Speisesalz enthält
Iodsalze wie
Kaliumiodat, die den Aufbau des Schilddrüsenhormons Thyroxin unterstützen. Dadurch können Iodsalze die Ausbildung eines Kropfes verhindern. Fluoridiertes Salz enthält
Fluorsalze wie Kaliumfluorid, das Karies vorbeugen soll.
Aufgrund der Eigenschaft des Kochsalzes, den Schmelzpunkt von Wasser herabzusetzen, kann es als Tausalz im Winter auf den Straßen eingesetzt werden. Die Verwendung von Streusalz ist problematisch. Es belastet die Bäche und Flüsse und schädigt die Bäume, die neben den Straßen gepflanzt sind. Der Rostvorgang bei Autokarosserien wird durch das Streusalz beschleunigt. In der chemischen Industrie ist Natriumchlorid ein wichtiger Rohstoff zur Herstellung von
Salzsäure,
Soda,
Chlor und
Natronlauge. Außerdem wird es von der Seifen- und Farbstoffindustrie benötigt.
In der Medizin verabreicht man bei großen Blutverlusten physiologische Kochsalzlösungen als Infusionen. Diese Lösungen besitzen eine Massenkonzentration von 0,9 % Natriumchlorid bei einer Dichte von 1,005 Gramm pro Milliliter bei 20 °C. In 1000 Gramm physiologischer Kochsalzlösung sind neun Gramm Salz gelöst. Bei anderen Konzentrationen würden die roten Blutkörperchen schrumpfen oder platzen.
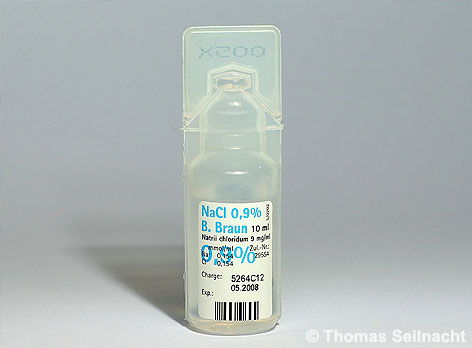
Physiologische 0,9%ige Kochsalz-Lösung.
Der menschliche Körper benötigt das Salz laufend durch die Nahrung, da es durch Harn, Schweiß und Tränenflüssigkeit ständig wieder ausgeschieden wird. Der durchschnittliche Mitteleuropäer verbraucht pro Tag etwa fünf Gramm Salz, in wärmeren Ländern ist der Salzverbrauch aufgrund der höheren Schweißproduktion wesentlich höher.
Weitere Infos und Medien
Infos zu den
Chloriden
Das Mineral
Halit
Herstellen von Kernseife nach dem Heißverfahren
Schülerübung:
Analyse unbekannter Substanzen
Demonstration:
Reaktion von Natrium und Chlor