| Inhalt Alkohol im Alltag Alkoholbegriff Einteilung und Eigenschaften Reaktionen der Alkohole Herstellung Verwendung |
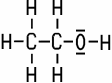 Ethanol | Die Alkohole stellen eine Stoffgruppe der organischen Chemie dar, die alle in ihrem strukturellen Aufbau mindestens eine OH-Gruppe besitzen. Diese wird als Hydroxy-Gruppe bezeichnet. Der in Getränken vorkommende Ethanol ist der bekannteste Vertreter. |
Alkohol im Alltag
Im Volksmund versteht man unter Alkohol eine trinkbare Flüssigkeit, die berauscht und in alkoholischen Getränken enthalten ist. Der Chemiker meint damit eine Gruppe von Stoffen, die nach einem ganz bestimmten Muster aufgebaut sind. Alkohole kommen in der Natur überall vor. So enthalten die meisten Früchte geringe Anteile Ethylalkohol (Ethanol), der durch natürliche Gärung entsteht. Fressen Vögel überreife Wacholderbeeren, kann es vorkommen, dass sie Anzeichen von Trunkenheit zeigen. Aus den Beeren wird durch Gärung Wacholderschnaps oder Gin gewonnen. Fruchtsäfte wie Apfelsaft oder Traubensaft enthalten Ethanol in geringer Konzentration. Sie können die Leber von Kleinkindern schädigen, da diese Ethanol noch nicht abbauen können. Alkohole wie Butanol oder Hexanol sind Komponenten der Fruchtaromen. Kompliziert aufgebaute Alkohole wie Linalool oder Geraniol finden sich in etherischen Ölen.
Schon die alten Griechen und Römer kannten die Wirkung von Wein. Allerdings war es im alten Rom den Frauen verboten, Wein zu trinken. Bierrezepte kannten bereits die Sumerer im Vierten Jahrtausend vor Christus. Das Getränk war in Germanien schon vor der Römerzeit bekannt. Die Germanen tranken es nach einer Überlieferung des römischen Schriftstellers Tacitus aus riesigen Trinkhörnern, die mit Bier und Honig-Met gefüllt waren. Sie betrieben mit den Römern Handel, lieferten Bier und erhielten dafür Gebrauchsgegenstände. Im Mittelalter übernahmen die Mönche die Herstellungstechnik und entwickelten die Kunst des Bierbrauens.
Alkoholbegriff und funktionelle Gruppe
Der Begriff Alkohol leitet sich vom arabischen Begriff „Al-Kuhl“ ab, was ursprünglich das schwarze Pigment Grauspießglanz (Antimonsulfid) bezeichnete, das zum Schwarzfärben der Augenlider verwendet wurde. Später übertrug man den Begriff auf alle feinpulvrigen Substanzen. Der Alchemist Paracelsus benutzte im 16. Jahrhundert den Begriff „alcool vini“ zur Bezeichnung des Stoffes, der bei der Alkoholdestillation gewonnen wurde. Der Chemiker kennt heute die Flüssigkeit unter der Bezeichnung Ethanol.

Nachweis eines Alkohols mit salpetersaurer Ammoniumcernitrat-Lösung (rechts)
In der Chemie ist der Begriff Alkohol
heute weiter gefasst: Man versteht darunter eine Stoffgruppe mit einem
ganz speziellen Aufbau im Molekül. Gibt man zu einem Alkohol
salpetersaure Ammoniumcer(IV)-nitrat-Lösung, färbt sich das
hellgelbe Reagenz orangerot. Die Reaktion findet mit jedem Stoff aus der Gruppe
der Alkohole statt. Es bildet sich dabei ein roter Komplex. Ursache ist die OH-Gruppe der Alkohole. Sie wird Hydroxy-Gruppe genannt (veraltet
„Hydroxyl-Gruppe“). Eine solche Atomgruppe,
die die chemischen Eigenschaften einer Stoffgruppe prägt, nennt man
auch funktionelle Gruppe. Die Hydroxy-Gruppe ist bei den Alkoholen mit aliphatischen Kohlenstoff-Atomen verbunden. Das
mit der Hydroxy-Gruppe verbundene Kohlenstoff-Atom darf bei den
Alkoholen nur noch mit Wasserstoff- oder weiteren Kohlenstoff-Atomen
verbunden sein. Daher werden die Carbonsäuren, trotz ihrer Hydroxy-Gruppen, nicht zu den Alkoholen gezählt.
Einteilung der Alkohole und Eigenschaften
Die einwertigen Alkohole, zu denen der allgemein bekannte, trinkbare Alkohol Ethylalkohol gehört, besitzen nur eine Hydroxy-Gruppe. Der Name wird aus dem Grundgerüst der vergleichbaren Alkane gebildet und erhält in der deutschen Sprache den Zusatz -yl. In der wissenschaftlichen Fachsprache wird die Endung -ol an den entsprechenden Alkylrest angehängt. So leitet sich die homologe Reihe der einwertigen Alkohole ab:
Der Begriff Alkohol leitet sich vom arabischen Begriff „Al-Kuhl“ ab, was ursprünglich das schwarze Pigment Grauspießglanz (Antimonsulfid) bezeichnete, das zum Schwarzfärben der Augenlider verwendet wurde. Später übertrug man den Begriff auf alle feinpulvrigen Substanzen. Der Alchemist Paracelsus benutzte im 16. Jahrhundert den Begriff „alcool vini“ zur Bezeichnung des Stoffes, der bei der Alkoholdestillation gewonnen wurde. Der Chemiker kennt heute die Flüssigkeit unter der Bezeichnung Ethanol.

Nachweis eines Alkohols mit salpetersaurer Ammoniumcernitrat-Lösung (rechts)
Einteilung der Alkohole und Eigenschaften
Die einwertigen Alkohole, zu denen der allgemein bekannte, trinkbare Alkohol Ethylalkohol gehört, besitzen nur eine Hydroxy-Gruppe. Der Name wird aus dem Grundgerüst der vergleichbaren Alkane gebildet und erhält in der deutschen Sprache den Zusatz -yl. In der wissenschaftlichen Fachsprache wird die Endung -ol an den entsprechenden Alkylrest angehängt. So leitet sich die homologe Reihe der einwertigen Alkohole ab:
| Methylalkohol | Ethylalkohol | Cetylalkohol | |
 |
 |
Propyl- alkohol Butyl- alkohol Pentyl- alkohol usw. |
 |
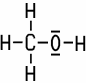 |
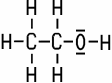 |
>>> | |
| CH3OH | C2H5OH | C16H33OH | |
| Methanol | Ethanol | Hexadecanol |
Bei der hier verwendeten
Darstellung des Cetylalkohol-Moleküls handelt es sich um die Skelettformel.
Dabei steht jeder Strich für eine C-C-Bindung. Die Zahl der Wasserstoff-Atome
lassen sich leicht ermitteln, da jedes Kohlenstoff-Atom vier Elektronenpaarbindungen
eingeht. Die Lewisformel (hier beim Methylalkohol
und Ethylalkohol) wird bei einfachen Verbindungen aus Anschauungszwecken
oft in der Schule verwendet, bei komplizierten Molekülen und in der
Wissenschaft verwendet man jedoch überwiegend die Skelettformel.
Cetylalkohol ist ein
langkettiger, einwertiger Alkohol mit 16 Kohlenstoff-Atomen. Wie bei den Alkanen steigen mit zunehmender Kettenlänge
aufgrund der steigenden Van-der-Waals-Kräfte die Siedetemperaturen.
Cetylalkohol ist bei Zimmertemperatur fest und bildet weiße, wachsartige
Plättchen.
| Schmelz und Siedepunkte einwertiger Alkohole |
| >Film |
Im Gegensatz zu den Alkanen,
sind die kurzkettigen Alkohole gut wasserlöslich. Dies lässt
sich mit Hilfe der Polarität im Molekül erklären. Methylalkohol besitzt eine relativ hohe
Polarität und ist daher nur wenig benzinlöslich. Doch bereits
beim Ethylalkohol bewirkt der kurze wasserabweisende Kettenrest (der hydrophobe
Alkylrest) eine Senkung der Polarität, so dass Ethylalkohol sowohl
in Wasser als auch in Benzin gut löslich ist. Mit zunehmender Kettenlänge
wird die polare Wirkung immer mehr aufgehoben, Butylalkohol ist in Wasser
bereits nur noch wenig löslich.
| Name | Summenformel | Schmelzpunkt | Siedepunkt | Wasserlöslichkeit |
| Methylalkohol (Methanol) | CH3OH | −98 °C | +65 °C | in jedem Verhältnis |
| Ethylalkohol (Ethanol) | C2H5OH | −114 °C | +78 °C | in jedem Verhältnis |
| Propylalkohol (Propan-1-ol) | C3H7OH | −124 °C | +97 °C | in jedem Verhältnis |
| Butylalkohol (Butan-1-ol) | C4H9OH | −89 °C | +118 °C | 80 g/l bei 25 °C |
| Pentylalkohol (Pentan-1-ol) | C5H11OH | −78 °C | +138 °C | 22,4 g/l bei 25 °C |
| Hexylalkohol (Hexan-1-ol) | C6H13OH | −47 °C | +158 °C | 6 g/l bei 25 °C |
| Laurylalkohol (Dodecan-1-ol) | C12H25OH | +24 °C | +264 °C | 0,004 g/l bei 25 °C |
| Cetylalkohol (Hexadecan-1-ol) | C16H33OH | +49 °C | +325 °C | unlöslich |
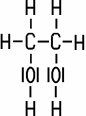
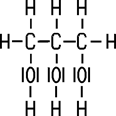
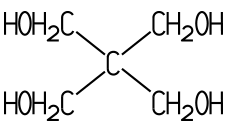
Sind in einem Molekül mehr als eine OH-Gruppe chemisch gebunden, handelt es sich um einen mehrwertigen Alkohol. Ethandiol (Ethylenglycol) besitzt im Molekül zwei OH-Gruppen und ist ein zweiwertiger Alkohol, Propantriol (Glycerin) als dreiwertiger Alkohol hat drei OH-Gruppen. Es existieren auch Alkohole mit mehr als drei Hydroxy-Gruppen:
| Ethylenglycol | Glycerin | Pentaerythrit | Sorbit |
 |
 |
Rohstoff zur Herstellung von Nitropenta (Sprengstoff) |
 |
| zweiwertig | dreiwertig | vierwertig |
sechswertig |
 |
 |
 |
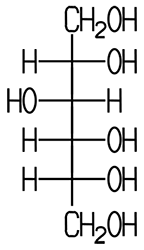 |
| Ethandiol | Propantriol | Pentaerythritol | D-Glucitol |
Die mehrwertigen Alkohole besitzen aufgrund der größeren Molekül-Masse und der höheren
Van-der-Waals-Kräfte einen höheren Siedepunkt. Außerdem
sind sie noch besser wasserlöslich als ein vergleichbarer einwertiger
Alkohol mit gleicher Anzahl C-Atome. Die mehrwertigen Alkohole besitzen
einen süßen Geschmack. Sorbit und Mannit sind keine Zucker, sie gehören zu den sechswertigen Alkoholen, bei
denen in einem Molekül sechs Hydroxy-Gruppen enthalten sind. Sie
werden aber als Zuckeralkohole bezeichnet, da sie durch
eine Reduktion aus Zuckern hergestellt werden können. Im
menschlichen Körper werden sie im Verdauungsprozess wieder zu
Zuckern umgebaut.
| Name | Summenformel | Strukturformel | Siedepunkt | Wasserlöslichkeit |
| Propan-1-ol (1-Propanol) | C3H7OH | 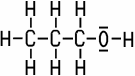 |
+97 °C | in jedem Verhältnis |
| Propan- 1,2,3-triol |
C3H5(OH)3 |  |
+289 °C | in jedem Verhältnis |
Zwei Hydroxy-Gruppen
an einem C-Atom sind nach der Erlenmeyer-Regel nicht stabil. Daher kommen
solche Stoffe nicht als beständige Verbindungen vor. Ab dem Propanol tritt bei den Alkoholen Isomerie auf. Nach
der Stellung der Hydroxy-Gruppe werden die Alkohole daher nochmals unterteilt:
1. Bei den primären
Alkoholen ist das mit der OH-Gruppe verbundene Kohlenstoff-Atom
mit keinem oder nur einem weiteren Kohlenstoff-Atom
verbunden.
2. Bei den sekundären Alkoholen ist das mit der OH-Gruppe verbundene Kohlenstoff-Atom mit zwei weiteren Kohlenstoff-Atomen verbunden.
3. Bei den tertiären Alkoholen ist es mit drei weiteren Kohlenstoff-Atomen verbunden.
2. Bei den sekundären Alkoholen ist das mit der OH-Gruppe verbundene Kohlenstoff-Atom mit zwei weiteren Kohlenstoff-Atomen verbunden.
3. Bei den tertiären Alkoholen ist es mit drei weiteren Kohlenstoff-Atomen verbunden.
| Primärer und sekundärer Alkohol im Vergleich |
Der sekundäre Alkohol Propan-2-ol (auch Isopropylalkohol, oder 2-Propanol) ähnelt in seinen physikalischen Eigenschaften dem Ethanol und wird als Desinfektionsmittel oder zum Reinigen von CDs, DVDs und Schallplatten eingesetzt. Die Flüssigkeit reizt Haut und Augen und kann nicht getrunken werden. Sie unterliegt daher nicht der Alkoholsteuer. Beim Butanol kommen vier Isomere vor. Butan-1-ol und 2-Methylpropan-1-ol sind primäre Alkohole, Butan-2-ol ist ein sekundärer und 2-Methylpropan-2-ol ein tertiärer Alkohol:
| n-Butanol |
sek-Butanol | tert-Butanol | iso-Butanol |
| |
 |
||
| Butan-1-ol | Butan-2-ol | 2-Methylpropan-2-ol | 2-Methylpropan-1-ol |
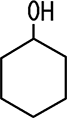
Cyclohexanol ist ein sekundärer Alkohol, weil das mit der OH-Gruppe verbundene Kohlenstoff-Atom mit zwei weiteren Kohlenstoff-Atomen im aliphatischen Ring verbunden ist. Phenol ist dagegen kein Alkohol. Die Hydroxy-Gruppe ist an einen aromatischen Ring gebunden.
| Alkohol sekundär | Phenol, kein Alkohol |
 |
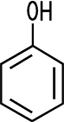 |
| Cyclohexanol | Phenol |
Beispiele für Reaktionen der Alkohole
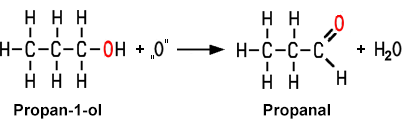
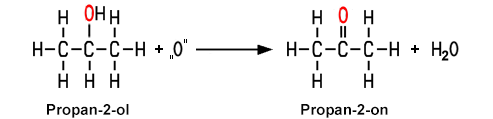
1. Oxidation der Alkohole
Die Isomere der Alkohole zeigen unterschiedliches Reaktionsverhalten bei Oxidationen. Bei der Oxidation eines primären Alkohols erhält man ein Aldehyd, bei der Oxidation eines sekundären Alkohols ein Keton. Tertiäre Alkohole lassen sich nicht mehr oxidieren. Durch eine enzymatische Reaktion, wenn man beispielsweise Wein längere Zeit an der Luft stehen lässt, oxidieren die primären Alkohole zu Carbonsäuren.
| Bei der Oxidation eines primären Alkohols entsteht ein Aldehyd |
 |
| Bei der Oxidation eines sekundären Alkohols entsteht ein Keton |
 |
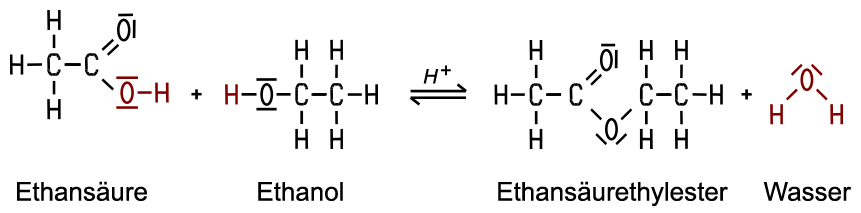
2. Ester-Reaktionen der Alkohole
Typische Reaktionen zeigen
die Alkohole beim Vorliegen von Wärme und Katalysatoren wie konzentrierte Schwefelsäure mit den Carbonsäuren,
wobei sich Ester bilden. Die Ester-Reaktion ist ein komplizierter Reaktionsmechanismus, der durch Protonen aus der Schwefelsäure
eingeleitet wird und in einzelnen Schritten abläuft. Durch verschiedene
Umbauten innerhalb der sich addierenden Moleküle wird am Ende Wasser
abgespalten und der Katalysator wieder
zurückgebildet.
3. Verhalten der Alkohole als schwache Säuren oder als schwache Basen
Alkohole können
als Brönsted-Säuren oder auch als Brönsted-Basen
reagieren. Bei der Reaktion mit Wasser ist die Entstehung eines
Alkoholat-Ions R-O− und eines Hydronium-Ions H3O+ möglich, da das positiv polarisierte Wasserstoff-Atom der Hydroxy-Gruppe ein Proton an eine Base abgeben kann. Allerdings sind die Alkohole nur ganz schwache Säuren. Der pKs-Wert
von Methanol beträgt zum Beispiel 15,5 und der von Ethanol 15,9.
Das Gleichgewicht dieser Reaktion liegt ganz stark auf der linken Seite:
R-OH + H2O R-O− + H3O+
R-O− + H3O+
Mit Natriumhydroxid erhält man Natriumalkoholat und Wasser. Das Alkoholat-Ion wird auch als Alkoxid-Ion bezeichnet:
R-OH + NaOH [R-O]−Na+ + H2O
[R-O]−Na+ + H2O
Dies erklärt auch, warum Alkohole mit Alkalimetallen unter Wasserstoffentwicklung reagieren. Bei der Reaktion von Ethanol mit Natrium entstehen Wasserstoff und Natriumethanolat (Natriumethoxid), ein cremefarbenes, hygroskopisches Pulver, das eine sehr starke Base darstellt:
R-OH + H2O
Mit Natriumhydroxid erhält man Natriumalkoholat und Wasser. Das Alkoholat-Ion wird auch als Alkoxid-Ion bezeichnet:
R-OH + NaOH
Dies erklärt auch, warum Alkohole mit Alkalimetallen unter Wasserstoffentwicklung reagieren. Bei der Reaktion von Ethanol mit Natrium entstehen Wasserstoff und Natriumethanolat (Natriumethoxid), ein cremefarbenes, hygroskopisches Pulver, das eine sehr starke Base darstellt:
CH3CH2-OH + 2 Na
Aufgrund der freien Elektronenpaare am Sauerstoff-Atom der Hydroxy-Gruppe können Alkohole auch als Basen reagieren. Sie nehmen von starken Säuren Protonen auf, so dass ein Oxonium-Ion O+H2 entsteht:
R-OH + H3O+
4. Eliminierungs- und Substitutions-Reaktionen der Alkohole
Bei einer Eliminierung treten aus einem Molekül zwei Atome oder Atomgruppen aus, ohne dass sie durch andere ersetzt werden. Erhitzt man Ethanol und konzentrierte Schwefelsäure auf über 200 °C, entsteht in einer Eliminierung Ethen, wobei gleichzeitig Wasser abgespalten wird:
C2H5OH
Diese Eliminierung gelingt mit sekundären und tertiären Alkohole leichter, dafür ist auch weniger Hitze erforderlich. Die Reaktion beruht auf der Fähigkeit der Hydroxy-Gruppe zur Bildung von Oxonium-Ionen mit starken Säuren. Beim Erhitzen spaltet sich ein Wasser-Molekül ab, und es entsteht in einer Zwischenstufe ein instabiles Carbenium-Ion, das ein positiv geladenes Kohlenstoff-Atom enthält. Dieses verursacht sofort die Ablösung eines Protons vom benachbarten Kohlenstoff-Atom, und es entsteht eine C=C-Doppelbindung. Die genaue Reaktion dieser Eliminierung stellt sich so dar:
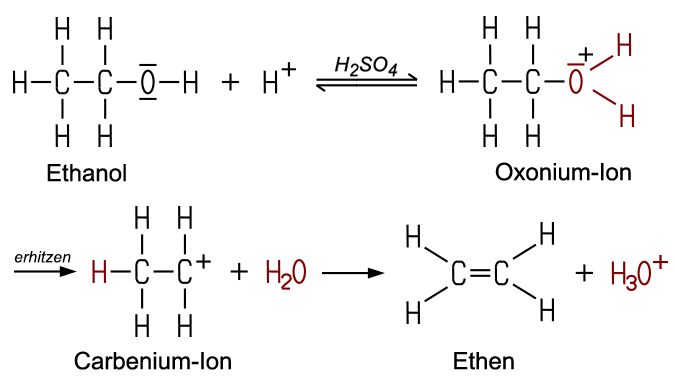
Mit Brom- oder Iodwasserstoff reagieren die Alkohole nicht in einer Eliminierung, sondern in einer Substitution zu einem Halogenalkan. Mit Bromwasserstoff HBr bildet zum Beispiel Methanol beim Erhitzen auf 200 °C Brommethan CH3Br und Wasser. Dabei wird die OH-Gruppe des Alkohols durch ein Brom-Atom ersetzt.
CH3OH + HBr
Herstellung der Alkohole
Der trinkbare Alkohol Ethanol wird durch alkoholische Gärung gewonnen.
Die synthetische Herstellung des Ethanols erfolgt durch Hydratisierung von Ethen. Als Nebenprodukt entsteht dabei Diethylether.
Dies wird in Ländern durchgeführt, die zu wenig
pflanzliche Rohstoffe für die Gewinnung von Ethanol für
technische Zwecke besitzen.
Methanol wurde früher durch die trockene Destillation von Holz gewonnen. Im Holzdestillat befand sich neben vielen anderen Produkten bis zu drei Prozent Methanol. Heute erfolgt die Methanol-Gewinnung hauptsächlich in einer exothermen Gleichgewichtsreaktion aus Synthesegas bei 400 °C und 200 Bar mit Hilfe eines ZnO/Cr2O3-Katalysators:
CO + 2 H2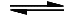 CH3OH ΔHR = −119 kJ/mol
CH3OH ΔHR = −119 kJ/mol
Propanol oder Cetylalkohol lassen sich mit einer Oxosynthese gewinnen. Alkohole können auch durch eine katalytische Hydrierung von Aldehyden und Ketonen hergestellt werden: Bei der Hydrierung werden zwei Wasserstoff-Atome in ein Alkohol-Molekül eingebaut. Die Hydrierung erfolgt mit Wasserstoff unter Zuhilfenahme von Platin- oder Palladium-Katalysatoren. Bei der Hydrierung von Cyclohexanon erhält man zum Beispiel Cyclohexanol.
Methanol wurde früher durch die trockene Destillation von Holz gewonnen. Im Holzdestillat befand sich neben vielen anderen Produkten bis zu drei Prozent Methanol. Heute erfolgt die Methanol-Gewinnung hauptsächlich in einer exothermen Gleichgewichtsreaktion aus Synthesegas bei 400 °C und 200 Bar mit Hilfe eines ZnO/Cr2O3-Katalysators:
CO + 2 H2
Propanol oder Cetylalkohol lassen sich mit einer Oxosynthese gewinnen. Alkohole können auch durch eine katalytische Hydrierung von Aldehyden und Ketonen hergestellt werden: Bei der Hydrierung werden zwei Wasserstoff-Atome in ein Alkohol-Molekül eingebaut. Die Hydrierung erfolgt mit Wasserstoff unter Zuhilfenahme von Platin- oder Palladium-Katalysatoren. Bei der Hydrierung von Cyclohexanon erhält man zum Beispiel Cyclohexanol.
Verwendung der Alkohole
Alkohole kommen im Haushalt nicht nur in alkoholischen Getränken vor. Im Brennspiritus ist Ethylalkohol mit einem Vergällungsmittel versetzt. Er wird als Reinigungsmittel verwendet. Die für Fondue erhältliche Brennpaste ist ein aus Ethylalkohol hergestelltes Gel, das als relativ handhabungssicher gilt. Angefärbter Ethylalkohol ist in den Thermometern enthalten. Isopropylalkohol ist ein medizinisches Desinfektionsmittel. Kurzkettige Alkohole dienen als Lösungsmittel für Farben und Lacke. Ethanol ist ein Lösungsmittel für Duftstoffe von Parfüms. Cetylalkohol ist ein umweltfreundlicher Emulgator und damit auch Salbengrundlage in kosmetischen Artikeln. Mehrwertige Alkohole wie Glycerin dienen in Hautcremes als Feuchthaltemittel. Das toxische Ethylenglycol findet sich in Frostschutzmitteln für Kraftfahrzeuge. Sorbit wird oft als versteckte Lebensmittelzutat im Brot, in Backwaren und Keksen, im Senf oder in Schokolade eingesetzt.
Die Brennpaste für Fondue wird aus Ethylalkohol und Calciumacetat hergestellt.
Für die chemische Industrie stellen die Alkohole wichtige Ausgangsstoffe dar: Mit Alkansäuren entstehen Ester, die als Geruchs- und Geschmacksstoffe für Lebensmittel und Parfüms verwendet werden. Essigsäureethylester ist ein bedeutendes Lösungsmittel für Lacke, Kunstharze oder Klebstoffe. Durch Oxidation der Alkohole erhält man Aldehyde und Ketone oder Alkansäuren wie die Essigsäure. Alkohole eignen sich auch als Treibstoffe für Kraftfahrzeuge oder Raketen. Die V2-Rakete im Zweiten Weltkrieg verbrannte in 70 Sekunden 3500 Kilogramm Ethanol mit 5250 Kilogramm Sauerstoff.


