 |
 Klare, farblose Flüssigkeit |
Molmasse 88,106 g/mol AGW 200 ml/m3 (TRGS 900) Dichte 0,9006 g/cm3 Schmelzpunkt −83,8 °C Siedepunkt +77,1 °C Wasserlöslk. Konz. bei 20 °C 86 g/l Brechungsindex (20°C) 1,3723 Explosionsgrz. 2 bis 11,5 Vol.-% (Luft) Flammpunkt −4 °C Zündpunkt +426 °C |
| Piktogramme GHS 02 GHS 07 Gefahr |
Gefahrenklassen
+ Kategorie Entzündbare Flüssigkeiten 2 Schwere Augenschädig./-reizung 2 Spezifische Zielorg.-Tox. (e. ZNS) 3 |
HP-Sätze (siehe auch Hinweis) H 225, 319, 336, EUH 066 P 210, 240, 261, 280.1-3, 305+351+338, 403+233 Entsorgung G 1 |
| Etikett drucken | Dt. Bezeichnung Synonyme (deutsch) |
Engl. Bezeichnung Synonyme (engl.) |
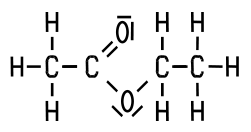
| CAS 141-78-6 | Ethylacetat Ethylethanoat Essigsäureethylester |
Ethyl acetate Ethylethanoate Acetic Ester |
Bemerkung
für Schulen: Ethylacetat ist eine leicht
entzündbare
Flüssigkeit. Die Dämpfe sind durch offene
Flammen leicht
entzündbar, es können sich auch
explosionsfähige Gemische
mit Luft bilden. Das Arbeiten erfolgt mit Schutzbrille
und
Schutzhandschuhen aus Butylkautschuk. In der Schule
bieten auch Handschuhe aus Nitrilkautschuk oder Neopren einen
kurzzeitigen Schutz. Auf eine gute Raumlüftung
ist zu achten oder es wird in einem geeigneten und
ständig
laufenden Abzug gearbeitet.
Eigenschaften Essigsäureethylester oder Ethylacetat löst sich etwa in der elffachen Menge Wasser. Sehr
gut löslich ist der Ester
in Ethylalkohol,
Diethylether, Aceton und Benzol. Die Dämpfe der
nach „Nagellackentferner“ oder „Uhu“ riechenden Flüssigkeit reizen
Atemwege und Augen. In höherer
Konzentration wirken die Dämpfe narkotisierend.
Essigsäureethylester
ist in Wasser schwach löslich, wo er unter Licht-
und Lufteinwirkung
langsam zu Ethanol und Essigsäure zerfällt und allmählich sauer reagiert. Der Ester
ist auch ein gutes Lösungsmittel für Öle, Fette, Lacke und
Kunstharze.
|
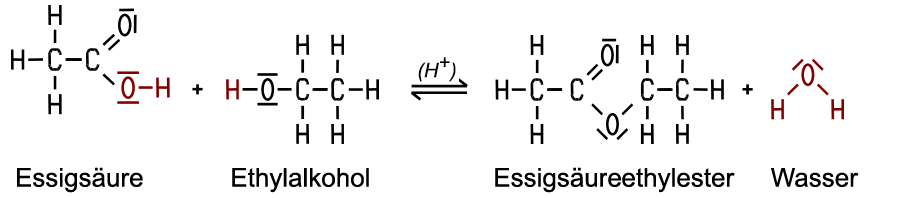
| Herstellung In der chemischen Inustrie gewinnt man den Ester aus Acetaldehyd nach dem Tischtschenko-Verfahren. Im Labor erfolgt die
Synthese aus Ethylalkohol und Essigsäure bei Gegenwart von Schwefelsäure als Katalysator
und Wärme in einer Gleichgewichtsreaktion. Die hier summarisch
dargestellte Esterreaktion ist ein komplizierter Reaktionsmechanismus, der durch Protonen aus der Schwefelsäure
eingeleitet wird und in einzelnen Schritten abläuft. Durch verschiedene
Umbauten innerhalb der sich addierenden Moleküle wird am Ende Wasser
abgespalten und der Katalysator wieder
zurückgebildet.
|
| Verwendung Ethylacetat dient zur Herstellung von künstlichen
Aromastoffen in Likören, Bonbons und Limonaden. Es ist ein wichtiges Lösungsmittel
bei der Herstellung von Lacken, Kunstharzen, Cellophan, Celluloid,
Klebstoffen, Nagellackentfernern, Kunstleder, Kunstseide, Nitrocellulose oder Explosivstoffen. |