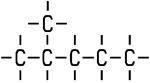 |
 |
 |
 |
Bei organischen Stoffen gibt es viele Stoffe, die zwar die gleiche Summenformel besitzen, sich aber in ihrem Molekülbau und ihren Stoffeigenschaften unterscheiden. Moleküle mit gleicher Summenformel, aber unterschiedlicher Struktur oder räumlicher Anordnungen nennt man Isomere. Es werden zwei Typen von Isomerie unterschieden, innerhalb denen es weitere Aufteilungen gibt:
1. Bei der Struktur-Isomerie oder Konstitutions-Isomerie sind die Atome innerhalb eines Moleküls unterschiedlich verknüpft. Die Isomere unterscheiden sich durch ihre Konstitution: Sie haben zwar die gleiche Summenformel, aber eine unterschiedliche Struktur. Eine Überführung ist nur durch Bindungsbruch möglich.
2. Bei der Stereo-Isomerie sind die Atome an den gleichen Stellen miteinander verknüpft, sie unterscheiden sich nur durch ihre räumliche Lage, durch ihre Konfiguration. Die Isomere haben die gleiche Summenformel und die gleiche Struktur. Eine Überführung ist nur durch Bindungsbruch möglich. Eine Ausnahme bilden die durch Drehung überführbaren Konformations-Isomere.
1. Struktur- Isomerie oder Konstitutions-Isomerie
1.1 Stellungs-Isomerie
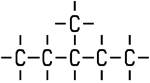
Wenn sich die Isomere im Hinblick auf die Stellung der funktionellen Gruppen oder der Stellung der Alkylreste unterscheiden, spricht man von Stellungs-Isomerie. Die Stoffeigenschaften der Isomere unterscheiden sich, eine Überführung ist nur durch Bindungsbruch möglich. Vom Hexan existieren fünf Isomere. Hexan (n-Hexan) und 2-Methyl-Pentan (Isohexan) besitzen zum Beispiel unterschiedliche Siedepunkte. Sie unterscheiden sich auch in ihrem chemischen Verhalten: Befindet sich im Autobenzin viel n-Hexan, neigt der Motor zu Frühzündungen. Dieses Phänomen wird als „Klopfen“ bezeichnet. Klopffestes Benzin enthält dagegen sehr viel verzweigtes Isohexan. Dieses Beispiel zeigt, dass sich Konstitutions-Isomere chemisch voneinander unterscheiden.
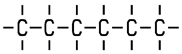 |
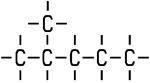 |
| Hexan (n-Hexan) Summenformel: C6H14 Siedepunkt: +69 °C |
2-Methyl-Pentan (Isohexan) Summenformel: C6H14 Siedepunkt: +60 °C |
Weitere Beispiele
n-Butan und 2-Methylpropan beim Butan
n-Pentan und 2-Methylbutan und 2,2-Dimethylpropan beim Pentan
Propan-1-ol und Propan-2-ol
Vier Isomere des Butanols
1-Naphthylamin und 2-Naphthylamin
o-Xylol, m-Xylol und p-Xylol
Isomerie bei der Glucose
1.2 Funktions-Isomerie
Besitzen zwei Stoffe
die gleiche Summenformel, aber unterschiedliche funktionelle Gruppen, dann
liegt eine Funktions-Isomerie vor. Dies ist
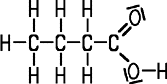
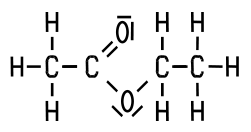
beispielsweise bei der Buttersäure und dem Essigsäurethylester der
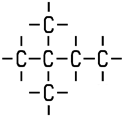
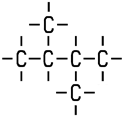
Fall. Diese beiden Stoffe gehören zu verschiedenen Stoffklassen. Sie zeigen auch völlig unterschiedliche chemisch-physikalische Eigenschaften.
 |
 |
| Butansäure (Buttersäure) Summenformel C4H8O2 |
Essigsäureethylester Summenformel C4H8O2 |
Weitere Beispiele
Diethylether und Butanol
2. Stereo-Isomerie
2.1 Konfigurations-Isomerie
a) Spiegelbild-Isomerie
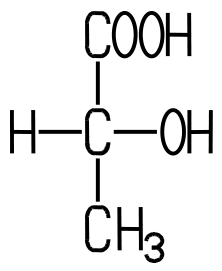
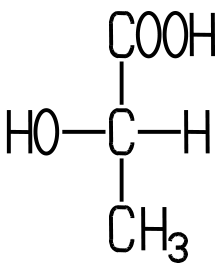
Bei der Spiegelbild-Isomerie oder Enantiomerie sind zwei Moleküle gleich verknüpft, verhalten sich aber wie Bild und Spiegelbild. Diese Art der Isomerie kommt bei fast allen Aminosäuren oder bei der Weinsäure vor. Die Enantiomere sind durch Drehung nicht ineinander überführbar. Sie besitzen gleiche chemisch-physikalische Eigenschaften wie gleicher Siedepunkt und gleiche Löslichkeit. Sie unterscheiden sich aber bei optisch aktiven Vorgängen, dies spielt beispielsweise bei der Verdauung durch Enzyme eine Rolle.
a) Spiegelbild-Isomerie
Bei der Spiegelbild-Isomerie oder Enantiomerie sind zwei Moleküle gleich verknüpft, verhalten sich aber wie Bild und Spiegelbild. Diese Art der Isomerie kommt bei fast allen Aminosäuren oder bei der Weinsäure vor. Die Enantiomere sind durch Drehung nicht ineinander überführbar. Sie besitzen gleiche chemisch-physikalische Eigenschaften wie gleicher Siedepunkt und gleiche Löslichkeit. Sie unterscheiden sich aber bei optisch aktiven Vorgängen, dies spielt beispielsweise bei der Verdauung durch Enzyme eine Rolle.
 |
 |
| D(-)-Milchsäure Siedepunkt +122 °C optisch linksdrehend |
L(+)-Milchsäure Siedepunkt +122 °C optisch rechtsdrehend |
Die vor allem in saurer Milch vorhandene Milchsäure enthält
zwei Spiegelbild-Enantiomere. Während die linksdrehende D(-)-Milchsäure
vorwiegend beim mikrobiologischen Abbau von Traubenzucker entsteht, kommt
die rechtsdrehende L(+)-Milchsäure im Blut, in der Muskulatur
und in den Organen der Tiere und Menschen vor. Schickt man linear polarisiertes
Licht durch die Lösungen der beiden Enantiomere, dreht sich die Schwingungsebene
bei der rechtsdrehenden L(+)-Milchsäure nach rechts und bei
der linksdrehenden D(-)-Milchsäure nach links. Dieses Phänomen
wurde von Louis Pasteur (1822-1895) entdeckt. Die saure Milch enthält
ein Gemisch beider optischer Enantiomere. Ein solches Gemisch wird auch Racemat genannt. Racemate kommen zum Beispiel auch bei der Weinsäure oder bei der Galactose vor.
Weitere Beispiele
L(+)-Weinsäure und D(-)-Weinsäure bei der Weinsäure
Äpfelsäure
Aspariginsäure
Campher
Cystein
Galactose
Mannit
b) Diastereomerie
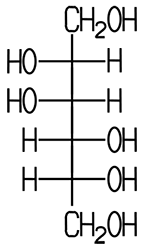
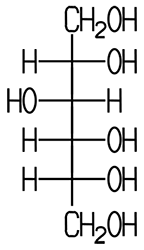
Unter die Diastereomerie fallen alle Isomere, die zwar stereoisomer sind, sich aber nicht wie Bild und Spiegelbild verhalten. Das D-Mannit-Molekül und das Sorbit-Molekül sind im Vergleich untereinander keine Enantiomere, trotzdem liegt eine Stereo-Isomerie vor: Sie sind Diastereomere. Sie unterscheiden sich in ihren chemisch-physikalischen Eigenschaften.
 |
 |
| D-Mannit Dichte 1,489 g/cm3 Schmelzpunkt +168 °C |
Sorbit Dichte 1,489 g/cm3 Schmelzpunkt +111 °C |
Weitere Beispiele
meso-Weinsäure und L(+)-Weinsäure bei der Weinsäure
Eine besondere Form der Diastereomerie ist die cis-trans-Isomerie. Hier liegen Atome oder Atomgruppen in Doppelbindungen oder in Ringen auf der gleichen Seite (cis) oder auf der gegenüberliegenden Seite (trans). Die Isomere lassen sich nicht durch Drehung ineinander überführen. Die cis-trans-Isomere des Butens unterscheiden sich in ihren chemisch-physikalischen Eigenschaften. Eine cis-trans-Isomerie kommt auch bei den ungesättigten Fettsäuren vor.
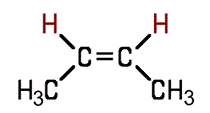 |
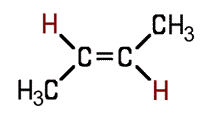 |
| cis-2-Buten Siedepunkt 3,7°C Dichte 0,621 g/cm³ |
trans-2-Buten Siedepunkt 0,9°C Dichte 0,604 g/cm³ |
Weitere Beispiele
Ölsäure und Elaidinsäure
Maleinsäure und Fumarsäure
2.2 Konformations-Isomerie
Bei
der Konformations-Isomerie lassen sich die
Moleküle der Isomere durch Drehung ohne Bindungsbruch ineinander überführen.
Ein bekanntes Beispiel ist die Sesselform und die Wannenform des Cyclohexans.
Die Sesselform ist die stabilste Form, weil alle Atomgruppen gestaffelt
zueinander stehen. Es existiert beim Cyclohexan sogar noch eine dritte
Konformation, die Twistform, bei der der Ring stark verdreht ist.
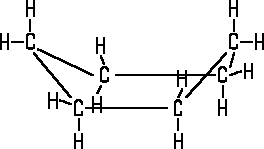 |
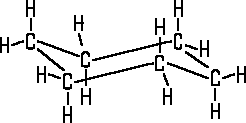 |
| Cyclohexan Wannenform |
Cyclohexan Sesselform |
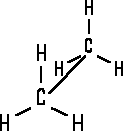
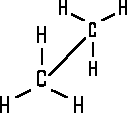
Liegen beim Ethan-Molekül
die Atome hintereinander, handelt es sich um die verdeckte Konformation,
werden sie um 60° gedreht, erhält man die gestaffelte Konformation.
Letztere ist energetisch günstiger und daher stabiler. Bei Raumtemperatur gleichen die
Moleküle durch ständige Bewegungen diese Energiedifferenz aus.
 |
 |
| Ethan Konformation verdeckt |
Ethan Konformation gestaffelt |
3. Gleicher Stoff oder unterschiedlicher Stoff?
Eine bedeutende Frage ist, ob Isomere zwei unterschiedliche Stoffe darstellen oder ob sie als ein Stoff gelten können. Nach IUPAC wird der Begriff chemical substance charakterisiert durch seine Entität („entities“), also dem atomaren und molekularen Aufbau, und durch seine physikalischen Eigenschaften „...such as density, refractive index, electric conductivity, melting point, etc.“ (IUPAC, Golden Book 2014). Nach dieser Definition sind alle Isomere unterschiedliche Stoffe, weil sie unterschiedliche physikalische Eigenschaften haben. Das Beispiel der Konformations-Isomerie zeigt aber, dass die Übergänge fließend sind. Bei Raumtemperatur gehen die beiden Konformationen laufend ineinander über. Hätte man Ethan-Moleküle in verdeckter und gestaffelter Konformation in reiner Form zur Verfügung, wären auch das zwei verschiedene Stoffe.
Buch individuell erstellen: Basis-Text Isomerie


> Inhaltsverzeichnis
Eine bedeutende Frage ist, ob Isomere zwei unterschiedliche Stoffe darstellen oder ob sie als ein Stoff gelten können. Nach IUPAC wird der Begriff chemical substance charakterisiert durch seine Entität („entities“), also dem atomaren und molekularen Aufbau, und durch seine physikalischen Eigenschaften „...such as density, refractive index, electric conductivity, melting point, etc.“ (IUPAC, Golden Book 2014). Nach dieser Definition sind alle Isomere unterschiedliche Stoffe, weil sie unterschiedliche physikalische Eigenschaften haben. Das Beispiel der Konformations-Isomerie zeigt aber, dass die Übergänge fließend sind. Bei Raumtemperatur gehen die beiden Konformationen laufend ineinander über. Hätte man Ethan-Moleküle in verdeckter und gestaffelter Konformation in reiner Form zur Verfügung, wären auch das zwei verschiedene Stoffe.
Buch individuell erstellen: Basis-Text Isomerie


> Inhaltsverzeichnis