Beim Arbeiten mit Silbernitrat oder deren Lösungen ist das Tragen von Schutzbrille und Schutzhandschuhe notwendig. Die Hände und der Arbeitsplatz sollten nach jeder Arbeit gut gewaschen werden. Mit Silbernitrat-Lösung benetzte Haut, Kleidung oder Arbeitsflächen müssen gut mit Wasser gereinigt werden, da sich sonst unter Lichteinwirkung schwarz-violette Silberüberzüge bilden, die nur schwer zu säubern sind. Generell sollte zum Chlorid-Nachweis nur frisch zubereitete Silbernitrat-Lösung verwendet werden. Diese wird in einer kleinen, schwarz lackierten PE-Tropfflasche mit 50 ml Volumen zur Verfügung gestellt. Reste müssen korrekt entsorgt werden. Die zum Verspiegeln verwendete ammoniakalische Silbernitrat-Lösung darf auf gar keinen Fall aufbewahrt werden, da sich hierbei explosive Kristalle bilden können. Es wird davon abgeraten, größere Mengen einzusetzen, eine Gefahr geht zum Beispiel bei Verspiegelungs-Experimenten aus. Die Durchführung der Tollens-Probe zum Nachweis von Kohlenstoffmonooxid an Schulen ist problematisch. Lösliche Silberverbindungen haben ein sehr hohes umweltgefährliches Potenzial (siehe letale Konzentration). Reste müssen sorgfältig gesammelt und sachgemäß entsorgt werden.
GBU Chlorid-Nachweis mit Silbernitrat und Tollens-Probe
Silber(I)-nitrat
AgNO3
CAS 7761-88-8
Silber(I)-nitrat
Silver(I) nitrate
169,873 g/mol
0,01 mg/m3 E (TRGS 900)
4,35 g/cm3
+210 °C
+440 °C
100g H2O lösen 219,2 g (L)
0,01 mg/m3 E (TRGS 900)
4,35 g/cm3
+210 °C
+440 °C
100g H2O lösen 219,2 g (L)
Weißes, kristallines Pulver
Dunkle Flasche

Gefahrenklassen + Kategorie
Oxidierende Feststoffe 2
Korrosiv gegenüber Metallen
Ätz-/Reizwirkung auf die Haut 1B
Gewässergefährd. akut/chron. 1
Oxidierende Feststoffe 2
Korrosiv gegenüber Metallen
Ätz-/Reizwirkung auf die Haut 1B
Gewässergefährd. akut/chron. 1
Silbernitrat bildet klare Kristalle, die im kristallinen Pulver weiß erscheinen. Das bitter metallisch schmeckende Silbersalz wirkt stark ätzend und bakterientötend. In Wasser ist es sehr gut löslich. Die Lösung reagiert schwach sauer. Schon Spuren in einem Gewässer können die Organismen darin töten.

Silber(I)-nitrat wird durch organische Stoffe wie Glycerin, aber auch durch Staubteilchen, besonders im Licht zu fein verteiltem, schwarzem Silber reduziert. Daher muss es unter Lichtabschluss aufbewahrt werden. Benetzte Haut färbt sich unter Lichteinwirkung nach ein paar Stunden bräunlich. Das auf der Hautoberfläche gebildete Silber baut sich nach einigen Tagen aber wieder ab. Früher wurde das Silbersalz zum Ätzen von Warzen verwendet. Aufgrund der Verfärbung auf der Haut nannte man es Höllenstein.
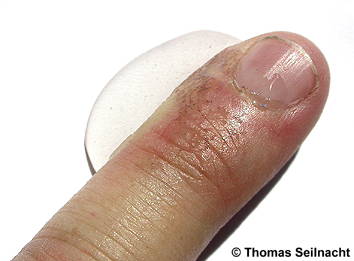

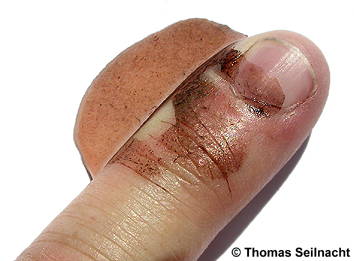

Nach einigen Minuten am Licht verfärbt sich der mit Silbernitrat-Lösung benetzte Finger braunschwarz.
Die Flecken können mit Kaliumiodid sofort entfernt werden. Gibt man zu einer Silber(I)-nitrat-Lösung Kaliumchlorid, flockt lichtempfindliches und im Wasser nicht mehr lösliches Silberchlorid aus:
Auf diese Art und Weise lassen sich viele Silbersalze herstellen: Mit Natriumhydroxid erhält man Silber(I)-oxid Ag2O, mit Natriumcarbonat Silber(I)-carbonat und mit Kaliumchromat kann man Silberchromat herstellen. Vermischt man eine Silber(I)-nitrat-Lösung mit Ethanol lässt sich das in den Knallerbsen vorhandene Silberfulminat oder Knallsilber CNOAg auskristallisieren (>rechtlicher Hinweis). Dieses ist noch viel berührungsempfindlicher als der Initial-Sprengstoff Knallquecksilber. Bei der Umsetzung von ammoniakalischer Silbernitrat-Lösung zu Silbernitrid Ag3N entsteht ebenfalls ein explosiver Stoff. Dieses „Knallsilber“ unterscheidet sich chemisch aber vom Silberfulminat oder vom Silberazid. Das Silberazid AgN3 wird durch die Reaktion von Natriumazid mit Silbernitrat dargestellt. Es detoniert schon bei bloßer Berührung.
Es ist sehr gefährlich, wenn ammoniakalische Silbernitrat-Lösungen zum Verspiegeln längere Zeit stehen bleiben oder aufbewahrt werden. Dann kristallisieren die explosiven Silbernitrid-Kristalle aus. Bloßes Drehen am Verschluss oder nur wenig Schütteln kann die Explosion auslösen. Die Versuchsanleitungen zum Verspiegeln müssen exakt eingehalten werden. Es sind nur ganz wenige Tropfen an verdünnter Ammoniaklösung notwendig. Es wird empfohlen, für Verspiegelungen nur kleine, saubere Reagenzgläser und pro Ansatz nicht mehr als 3 Milliliter der Lösung zu verwenden. Die Verspiegelungs-Lösung wird stets im zu verspiegelnden Reagenzglas direkt hergestellt. Da das Silbernitrat bei dieser Versuchsvariante normalerweise vollständig reduziert wird, können die Rest-Lösungen sofort nach dem Versuch im Abwasser entsorgt werden. Sind Reste an Silbernitrat vorhanden, kann das Silber durch Zugabe von Glucose reduziert werden. Dabei ist es von Bedeutung, dass alle beteiligten Gefäße gut durchgespült werden. Das Tragen einer Schutzbrille ist unbedingt vorgeschrieben.
Tollens Reagenz ist ein Gemisch von 10%iger Silbernitrat-Lösung und 10%iger Natronlauge, dem wenig Ammoniaklösung zugesetzt wird, bis die gerade auftretende Silberoxid-Fällung wieder verschwindet. Die Tollens-Probe dient zum Nachweis von reduzierend wirkenden funktionellen Gruppen. Aldehyde werden mit Tollens Reagenz zu Alkansäuren oxidiert, wobei elementares Silber entsteht. Beim Einleiten von Kohlenstoffmonooxid in Tollens Reagenz wird Kohlenstoffmonooxid zu Kohlenstoffdioxid oxidiert. Man kann mit der Tollens-Probe Kohlenstoffmonooxid in geringen Mengen nachweisen. Die Durchführung der Tollens-Probe an Schulen ist problematisch, da die Lösung nur frisch angesetzt werden darf und die Reste korrekt zu entsorgen sind. Es wird empfohlen, stattdessen ein elektronisches Nachweisgerät für Kohlenstoffmonooxid einzusetzen, wie es im Elektronikbedarf erhältlich ist.

Silber(I)-nitrat wird durch organische Stoffe wie Glycerin, aber auch durch Staubteilchen, besonders im Licht zu fein verteiltem, schwarzem Silber reduziert. Daher muss es unter Lichtabschluss aufbewahrt werden. Benetzte Haut färbt sich unter Lichteinwirkung nach ein paar Stunden bräunlich. Das auf der Hautoberfläche gebildete Silber baut sich nach einigen Tagen aber wieder ab. Früher wurde das Silbersalz zum Ätzen von Warzen verwendet. Aufgrund der Verfärbung auf der Haut nannte man es Höllenstein.
Nach einigen Minuten am Licht verfärbt sich der mit Silbernitrat-Lösung benetzte Finger braunschwarz.
Die Flecken können mit Kaliumiodid sofort entfernt werden. Gibt man zu einer Silber(I)-nitrat-Lösung Kaliumchlorid, flockt lichtempfindliches und im Wasser nicht mehr lösliches Silberchlorid aus:
AgNO3 + KCl  AgCl + KNO3
AgCl + KNO3
Auf diese Art und Weise lassen sich viele Silbersalze herstellen: Mit Natriumhydroxid erhält man Silber(I)-oxid Ag2O, mit Natriumcarbonat Silber(I)-carbonat und mit Kaliumchromat kann man Silberchromat herstellen. Vermischt man eine Silber(I)-nitrat-Lösung mit Ethanol lässt sich das in den Knallerbsen vorhandene Silberfulminat oder Knallsilber CNOAg auskristallisieren (>rechtlicher Hinweis). Dieses ist noch viel berührungsempfindlicher als der Initial-Sprengstoff Knallquecksilber. Bei der Umsetzung von ammoniakalischer Silbernitrat-Lösung zu Silbernitrid Ag3N entsteht ebenfalls ein explosiver Stoff. Dieses „Knallsilber“ unterscheidet sich chemisch aber vom Silberfulminat oder vom Silberazid. Das Silberazid AgN3 wird durch die Reaktion von Natriumazid mit Silbernitrat dargestellt. Es detoniert schon bei bloßer Berührung.
Es ist sehr gefährlich, wenn ammoniakalische Silbernitrat-Lösungen zum Verspiegeln längere Zeit stehen bleiben oder aufbewahrt werden. Dann kristallisieren die explosiven Silbernitrid-Kristalle aus. Bloßes Drehen am Verschluss oder nur wenig Schütteln kann die Explosion auslösen. Die Versuchsanleitungen zum Verspiegeln müssen exakt eingehalten werden. Es sind nur ganz wenige Tropfen an verdünnter Ammoniaklösung notwendig. Es wird empfohlen, für Verspiegelungen nur kleine, saubere Reagenzgläser und pro Ansatz nicht mehr als 3 Milliliter der Lösung zu verwenden. Die Verspiegelungs-Lösung wird stets im zu verspiegelnden Reagenzglas direkt hergestellt. Da das Silbernitrat bei dieser Versuchsvariante normalerweise vollständig reduziert wird, können die Rest-Lösungen sofort nach dem Versuch im Abwasser entsorgt werden. Sind Reste an Silbernitrat vorhanden, kann das Silber durch Zugabe von Glucose reduziert werden. Dabei ist es von Bedeutung, dass alle beteiligten Gefäße gut durchgespült werden. Das Tragen einer Schutzbrille ist unbedingt vorgeschrieben.
Tollens Reagenz ist ein Gemisch von 10%iger Silbernitrat-Lösung und 10%iger Natronlauge, dem wenig Ammoniaklösung zugesetzt wird, bis die gerade auftretende Silberoxid-Fällung wieder verschwindet. Die Tollens-Probe dient zum Nachweis von reduzierend wirkenden funktionellen Gruppen. Aldehyde werden mit Tollens Reagenz zu Alkansäuren oxidiert, wobei elementares Silber entsteht. Beim Einleiten von Kohlenstoffmonooxid in Tollens Reagenz wird Kohlenstoffmonooxid zu Kohlenstoffdioxid oxidiert. Man kann mit der Tollens-Probe Kohlenstoffmonooxid in geringen Mengen nachweisen. Die Durchführung der Tollens-Probe an Schulen ist problematisch, da die Lösung nur frisch angesetzt werden darf und die Reste korrekt zu entsorgen sind. Es wird empfohlen, stattdessen ein elektronisches Nachweisgerät für Kohlenstoffmonooxid einzusetzen, wie es im Elektronikbedarf erhältlich ist.
Durch das Auflösen von Silber in konzentrierter Salpetersäure erhält man Silber(I)-nitrat, wobei sich Stickstoffmonooxid bildet:
Das Stickstoffmonooxid (NO) geht bei der Berührung mit der Luft in rotbraunes Stickstoffdioxid NO2 über. Dieser Versuch darf nur in einem gut gelüfteten Abzug durchgeführt werden, da die Stickoxide sehr toxisch sind.
3 Ag + 4 HNO3  3 AgNO3 + 2 H2O + NO
3 AgNO3 + 2 H2O + NO
Das Stickstoffmonooxid (NO) geht bei der Berührung mit der Luft in rotbraunes Stickstoffdioxid NO2 über. Dieser Versuch darf nur in einem gut gelüfteten Abzug durchgeführt werden, da die Stickoxide sehr toxisch sind.
Die chemische Industrie benötigt Silbernitrat zur Herstellung anderer Silberverbindungen wie Silberchlorid oder Silberiodid. Diese waren lange Zeit Bestandteil der lichtempfindlichen Fläche von Filmen für die analoge Fotografie. In der Galvanotechnik lassen sich mit Silbernitrat galvanische Versilberungen durchführen. Früher diente Silbernitrat als Ätzmittel gegen Warzen, zum Schwarzfärben von Haaren und zur Herstellung nicht auslöschbarer Tinten. Im Labor ist die wässrige Lösung ein wichtiges Reagenz zum analytischen Nachweis der Halogenide.
Analytik
Chloride sowie Salzsäure bilden mit Silber(I)-nitrat schwer lösliches Silber(I)-chlorid AgCl, das als weißer Niederschlag aus der Flüssigkeit ausfällt. Bei der Reaktion von Natriumchlorid mit Silber(I)-nitrat erhält man Silber(I)-chlorid und Natriumnitrat.
Zur Herstellung einer Silber(I)-nitrat-Lösung mit der ungefähren Konzentration 0,1 mol/l löst man 1,7 g Silber(I)-nitrat in 50 ml destilliertem Wasser und füllt dann mit Wasser auf 100 ml auf.
Weitere Infos und didaktisches Material
Durchführung einer chemischen Analyse im virtuellen Labor
Chloride im Lexikon der Säuren, Basen und Salze
Silbersalze in der Fotografie.
Schülerübung: Spiegel aus Glycerin und Silbernitrat herstellen
Tollens-Probe auf reduzierend wirkende funktionelle Gruppen
Analytik
Chloride sowie Salzsäure bilden mit Silber(I)-nitrat schwer lösliches Silber(I)-chlorid AgCl, das als weißer Niederschlag aus der Flüssigkeit ausfällt. Bei der Reaktion von Natriumchlorid mit Silber(I)-nitrat erhält man Silber(I)-chlorid und Natriumnitrat.
AgNO3 + NaCl  AgCl ↓ + NaNO3
AgCl ↓ + NaNO3
Zur Herstellung einer Silber(I)-nitrat-Lösung mit der ungefähren Konzentration 0,1 mol/l löst man 1,7 g Silber(I)-nitrat in 50 ml destilliertem Wasser und füllt dann mit Wasser auf 100 ml auf.
Weitere Infos und didaktisches Material
Durchführung einer chemischen Analyse im virtuellen Labor
Chloride im Lexikon der Säuren, Basen und Salze
Silbersalze in der Fotografie.
Schülerübung: Spiegel aus Glycerin und Silbernitrat herstellen
Tollens-Probe auf reduzierend wirkende funktionelle Gruppen
© Thomas Seilnacht / Benutzerhandbuch / Lizenzbestimmungen / Impressum / Datenschutz / Literaturquellen
