 |
Weißes, kristallines Pulver |
Molmasse 168,358 g/mol AGW keine Angaben Dichte 3,988 g/cm3 Schmelzpunkt +646 °C Siedepunkt +1297 °C Wasserlöslichkeit (Löslichkeitsangabe) 100g H2O lösen bei 20 °C 187,0 g |
| Piktogramme
GHS 08 Achtung |
Gefahrenklassen
+ Kategorie Reproduktionstoxizität 2 |
HP-Sätze (siehe auch Hinweis)
H 361 P 280.1-3,7 Entsorgung G 4 |
| Etikett drucken | Deutscher Name | Englischer Name |
| CAS 7647-17-8 | Caesiumchlorid |
Cesium chloride |
| Eigenschaften Caesiumchlorid bildet farblose Kristalle nach dem kubischen System.
In gemahlener Form erscheint das kristalline Pulver weiß, es
sieht ähnlich aus wie Kochsalz, es ist aber schwerer als dieses. Caesiumchlorid ist besser wasserlöslich und auch wesentlich stärker hygroskopisch als Natriumchlorid. Im Gegensatz zum Natriumchlorid und zum Rubidiumchlorid sind die Kristalle nach der Caesiumchlorid-Struktur aufgebaut: Im Ionengitter ist jedes Caesium-Ion von acht Chlorid-Ionen umgeben und umgekehrt. Man
kann sich zum Beispiel das Caesium-Ion im Zentrum eines Würfels
vorstellen, die Chlorid-Ionen wären dann an den acht Ecken des
Würfels. 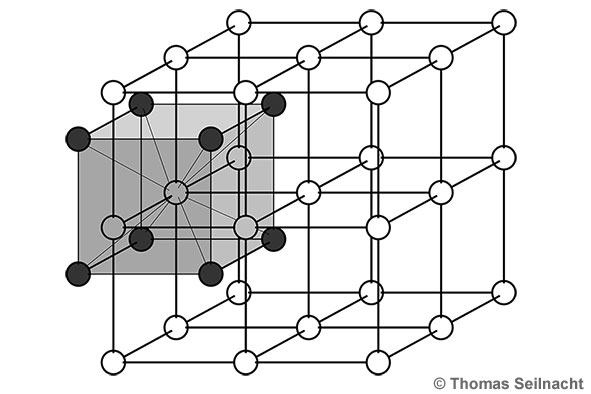 Caesiumchlorid-Struktur als Ionengittermodell Die unterschiedlichen Eigenschaften des Salzes im Vergleich zum Natriumchlorid zeigen sich auch unter dem Mikroskop: Legt man einen Tropfen konzentrierte, wässrige Caesiumchloridlösung auf einen Objektträger, kann man beobachten, wie typische Gittermuster entstehen. Im Vergleich zum Natriumchlorid entstehen bei dieser Versuchsanordnung keine Würfel.  Gitterstrukuren beim Auskristallisieren des Caesiumchlorids unter dem Mikroskop |
| Herstellung Caesiumchlorid kann
man im Labor herstellen, wenn Caesiumcarbonat oder Caesiumhydroxid mit
Salzsäure reagiert. Die industrielle Herstellung erfolgt aus den
Caesium-Mineralien Pollucit oder Lepidolith. Durch verschiedene Aufschlussverfahren erhält man als Rohprodukt Caesiumcarbonat. |
| Verwendung
Caesiumchlorid wird im Chemieunterricht in der Flammenspektroskopie eingesetzt. Dabei zeigt sich die typische Flammenfarbe des
Caesium-Ions. Im biotechnologischen Labor wird Caesiumchlorid zum
Reinigen von Nucleinsäuren verwendet. Es wird auch für
Röntgen-Fluoreszenz-Schirme benötigt.
|
