In einer Brennstoffzelle wird chemische Energie in einem galvanischen Element durch das regelmäßige Zuführen eines Brennstoffs mit einem Oxidationsmittel in elektrische Energie umgewandelt. Im Gegensatz zu einer Batterie ist die Energie in der Brennstoffzelle nicht gespeichert; während des Betriebs wird ein Brennstoff zusammen mit dem Oxidationsmittel kontinuierlich zugeführt. Bei einer Wasserstoff-Sauerstoff-Brennstoffzelle reagiert Wasserstoff mit Sauerstoff zu Wasser, das aus der Brennstoffzelle laufend entnommen wird. Die Reaktionsgleichung entspricht der Knallgasreaktion, die Reaktion verläuft aber nicht explosionsartig, sondern geregelt:
2 H2 + O2
Der deutsch-schweizerische Chemiker Christian Friedrich Schönbein (1799–1868) tauchte um 1838 zwei Platindrähte in eine elektrisch leitfähige Flüssigkeit und umspülte sie mit Wasserstoff und Sauerstoff. Aufgrund der messbaren Spannung vermutete er, dass es möglich sein könnte, die „chemische Energie des Knallgases“ in Elektrizität verwandeln zu können. Als eigentlicher Vater der Brennstoffzelle gilt aber der englische Naturwissenschaftler Sir William Grove (1811–1896). Grove beobachtete das Phänomen, dass nach einer Elektrolyse von Wasser eine elektrische Spannung an den Elektroden auftrat. Im Labor kann man ein ähnliches Experiment durchführen, wenn man mit zwei Kohle-Elektroden eine verdünnte Kalilauge elektrolysiert und nach dem Ende der Elektrolyse eine Spannungsmessung durchführt. Die in den feinen Poren der Kohle adsorbierten Wasserstoff- und Sauerstoffanteile reichen aus, um einige Zeit den Effekt aufrecht zu erhalten und sogar einen kleinen Solarmotor zu betreiben.
Grove konnte nachweisen, dass der zuvor an den Platin-Elektroden gebildete Wasserstoff und Sauerstoff an den Elektroden reagierte und so die elektrische Energie erzeugte. Schon 1842 baute er eine Batterie, bestehend aus mehreren galvanischen Wasserstoff-Sauerstoff-Elementen. Grove experimentierte auch mit anderen Brennstoffen, die sich in einem galvanischen Element mit Sauerstoff oxidieren lassen, beispielsweise mit Ether, mit Alkoholen, mit Ölen oder mit Campher [Lit Glöckner 1994].
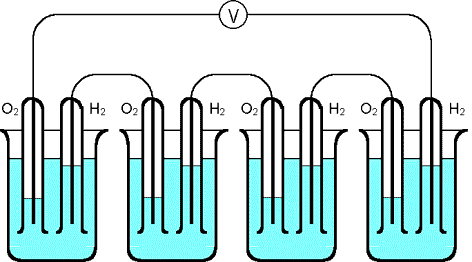
verdünnte Schwefelsäure, die Glasröhren sind jeweils mit Wasserstoff und Sauerstoff gefüllt.
Darin befinden sich Platin-Elektroden. Der Voltmeter zeigt die elektrische Spannung an.
Grove versorgte mit dem erzeugten elektrischen Strom einen Elektrolyseur,
in dem Wasser wieder in Wasserstoff und Sauerstoff zerlegt wurde.
Die oben gezeigte Anordnung
erzeugt trotz der Hintereinanderschaltung der vier galvanischen Elemente
nur Stromstärken von wenigen Milliampere. Zur Erzeugung einer höheren
Stromdichte müssen poröse Platten-Elektroden eingesetzt werden.
Dadurch ist gewährleistet, dass die Oberfläche der sogenannten
„Dreiphasenzone“ vergrößert wird, nur dort findet eine schnelle
Wanderung der Wasserstoff-Ionen statt. Damit wird die Stelle bezeichnet,
an der die Elektrode, der Elektrolyt und die Gasphase direkt zusammentreffen
[Lit Hamann 2005] .
In der Anordnung nach Grove hat man eine solche Zone nur am Kontakt der
Platinelektroden mit den Flüssigkeitsoberflächen innerhalb der
Glasröhren. Zur Erhöhung der Stromdichte benötigt es poröse
Trägermaterialien wie Kohlenstoffnanoröhren, gepresste Aktivkohle
oder Sinternickel, die mit katalytisch wirkenden Metallen wie Platin, Palladium
oder Ruthenium beschichtet sind. Die Gase perlen durch diese Schichten
und durchdringen sie intensiv. In einer Brennstoffzelle muss der Elektrolyt
wie eine Sperrschicht wirken, da sich sonst die elektrische Spannung über
den Elektrolyt direkt entladet, ohne dass sie zwischen den beiden Elektroden
genützt werden könnte [Lit
Internet Leuschner 2011].
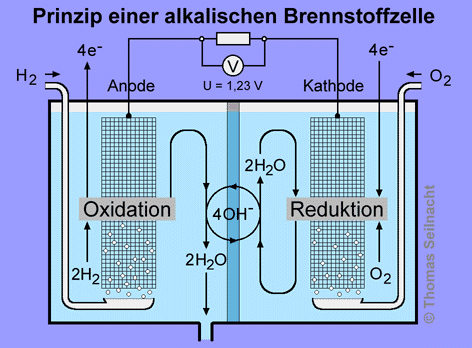
Der prinzipielle Aufbau
einer Brennstoffzelle soll anhand der alkalischen Brennstoffzelle (AFC,
Alkaline Fuel Cell) erläutert werden. Dieser Typ wurde bei den Apollo-Mondflügen
der NASA zur Energieversorgung der Apollo-Raumfahrzeuge eingesetzt. Als
Elektrolyt wird Kalilauge, eine wässrige
Lösung von Kaliumhydroxid in Wasser,
verwendet. Wasserstoff wird an der Anode, Sauerstoff
an der Kathode umgesetzt. In den Apollo-Raumschiffen wog ein Wasserstoff-Sauerstoff-Zellen-Modul
110 Kilogramm. Es lieferte 1120 Watt Leistung bei einer Spannung von 28 Volt. Im
Vergleich dazu wäre ein Bleiakku erheblich schwerer gewesen [vgl.
Lit Hamann 2005]. Im späteren
Space Shuttle waren drei Brennstoffzellen-Anlagen im vorderen Teil des
Raumschiffes untergebracht. Jede Anlage erzielte 2000 Watt Leistung. Über
einen zeitlich begrenzten Zeitraum von 15 Minuten konnte jede Anlage sogar
bis zu 12000 Watt erzeugen [Lit
Schmidt-Walter] .
Ein Nachteil der alkalischen
Brennstoffzelle liegt darin, dass Luft als Oxidationsmittel nicht geeignet
ist. Das darin enthaltene Kohlenstoffdioxid würde in der Lauge zu
Carbonat reagieren und die Leistung der Brennstoffzelle herabsetzen. Daher
kann sie nur mit reinem Sauerstoff betrieben werden. Die Betriebstemperatur
liegt zwischen 20 und 90 °C, es kann ein Wirkungsgrad bis zu 83 %
erreicht werden. Die theoretisch erzielbare Spannung beträgt 1,23
Volt, die tatsächlich verfügbare Spannung liegt aber nur bei höchstens
einem Volt. Im Vergleich zu Brennstoffzellen mit festen Membranen (PEFC,
PEMFC) ist der Wirkungsgrad besser, die Leistungsdichte aber etwas schwächer.
Zum Aufbau einer alkalischen
Brennstoffzelle im Schullabor eignen sich mit Platin
oder mit Palladium beschichtete Nickeldrahtnetze.
Als Diaphragma zur Trennung der Zelle wird poröser Ton verwendet.
Zum Einsatz kommt verdünnte Kalilauge. Alternativ dazu werden in der
Literatur auch Versuchsanleitungen beschrieben, bei denen eine
Kaliumnitrat-Lösung mit der Konzentration 1 Mol pro Liter eingesetzt
wird. In diesem Fall kann man einen dünnen Kartonstreifen als Trennwand
verwenden [Lit Glöckner
1994] .
Im Vergleich zur Knallgasreaktion
wird die Gesamtreaktion – bestehend aus Oxidation
und Reduktion – bei der alkalischen Wasserstoff-Sauerstoff-Brennstoffzelle
in einzelne Schritte aufgespalten. An der Anode oxidiert Wasserstoff unter
Elektronenabgabe. An der Kathode wird Sauerstoff unter Elektronenaufnahme
reduziert. Die Hydroxid-Ionen OH− der Kalilauge
dienen dabei als Ladungsträger in der Lösung.
| Oxidation an der Anode (Minuspol) | 2 H2 +
4 OH− |
| Reduktion an der Kathode (Pluspol) | O2 + 2 H2O
+ 4 e− |
| Gesamtreaktion | 2 H2 +
O2 |
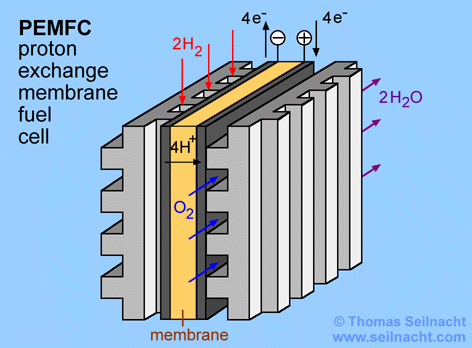
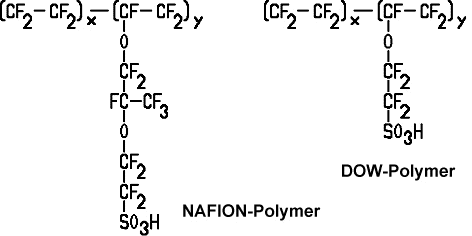
Bei der Protonenaustauschmembran-Brennstoffzelle (PEMFC) kann ebenfalls Wasserstoff und Sauerstoff in Wasser umgewandelt werden. Die im Lehrmittelhandel erhältlichen, reversiblen Brennstoffzellen, die gleichzeitig auch als Elektrolyseur dienen, gehören in der Regel zu diesem Typ. Eine Direktmethanol-Brennstoffzelle (DMFC) ist ähnlich aufgebaut, nur verwendet sie Methanol oder ein Methanol-Wassergemisch statt Wasserstoff. Ein weiterer Vorteil der Brennstoffzellen mit Membran ist, dass auch ein Betrieb mit Luft möglich ist (statt mit Sauerstoff). Die PEMFC verwendet als Elektrolyt keine Flüssigkeit, sondern eine Polymer-Membran (in der Grafik unten orange). Nafion lässt sich durch eine Fluorierung und Sulfonierung von Teflon herstellen, es ist ein Kunststoff, der Protonen und Kationen leitet, während Anionen gesperrt werden. Daher ist Nafion ein optimaler Elektrolyt für Membranen in PEMFC-Brennstoffzellen. Das Nafion kam erstmals um 1969 in einem Satelliten zum Einsatz. Die Firma DOW-Chemical entwickelte später das DOW-Polymer, das eine noch höhere Leistungsdichte ermöglicht [Lit Ledjeff-Hey, u.a. 2001] .
Die Elektroden können aus Kohlenstoff aufgebaut sein (in der Grafik dunkelgrau), der mit einem Metall als Katalysator benetzt ist. Hierfür eignen sich Platin und Ruthenium oder Platin und Nickel. Auf die Elektrode wird eine Gasdiffusionslage (GDL) gepresst. Diese Schicht besteht aus einem Fasergewebe aus Graphit. Sie ermöglicht, dass die Gase fein zerteilt an die Elektrode herangeführt werden, außerdem reguliert sie einen optimalen Verlauf der Reaktion.
| Oxidation an der Anode (Minuspol) | 2 H2 |
| Reduktion an der Kathode (Pluspol) | O2 + 4 H+
+ 4e− |
| Gesamtreaktion | 2 H2 +
O2 |
Die Grafik stellt den Aufbau einer PEMFC vereinfacht dar. Die tatsächlichen Schichtdicken sind viel geringer als dargestellt. So werden pro Quadratzentimeter nur 0,1 Milligramm Edelmetall aufgetragen und die Elektrolytfolie ist höchstens 0,1 Millimeter dünn. Insgesamt beträgt die Dicke der gesamten PEMFC-Einheit nur etwa einen halben Millimeter! Mit einem Quadratzentimeter kann eine Leistung von einem halben Watt erzeugt werden [Lit Pehnt] . Der Wirkungsgrad ist etwas niedriger im Vergleich zur alkalischen Brennstoffzelle, dafür ist die Leistungsdichte höher. Außerdem wirkt der feste Elektrolyt nicht korrosiv, die Haltbarkeit der Zelle ist daher ein weiterer Vorteil. Der optimale Temperaturbereich liegt bei 60 bis 120 °C. Die katalytische Wirkung wird durch Verunreinigungen mit Kohlenstoffmonooxid herabgesetzt. Dies ist dann der Fall, wenn statt dem Wasserstoff Synthesegas als Brennstoff eingesetzt wird. Theoretisch würde die Spannung 1,23 Volt betragen, aber auch bei diesem Brennstoffzellentyp erreicht man in der Praxis nur Spannungen von 0,6 bis 0,9 Volt. Durch eine Reihenschaltung mehrerer Einheiten erhält man Stacks oder Stapel mit einer höheren Entnahmespannung. Im Handel sind Stacks von fünf bis einhundert Einheiten erhältlich. Die Einzelzellen sind dabei jeweils durch eine Bipolarplatte verbunden.
Neben der alkalischen
Brennstoffzelle und der PEMFC gibt es noch weitere Typen mit unterschiedlichen
Elektrolyten. Bei der Phosphorsäure-Brennstoffzelle (PAFC) wird Phosphorsäure
in Gelform als Elektrolyt und Wasserstoff oder Methan
als Brennstoff verwendet. Diese Brennstoffzelle benötigt eine relativ
hohe Betriebstemperatur von etwa 200 °C. Noch höhere Temperaturen
sind für den Betrieb der Schmelzcarbonat-Brennstoffzelle (MCFC, 650 °C)
oder bei der oxidkeramischen Brennstoffzelle (SOFC, 800 °C) notwendig.
Der Vorteil dieser beiden Typen besteht darin, dass sie auch mit Kohlegas
oder Biogas betrieben werden können. Die SOFC verwendet eine ionenleitende
Keramik aus Zirkonoxid mit einer Beigabe von Yttriumoxid als Elektrolyt.
Weitere Informationen
Arbeitsblätter
Solarenergie
Wasserstoff
im Periodensystem
Experimente
mit Wasserstoff und Wasserstoffauto
Weitere Infos im Internet
Brennstoffzellen
(Prof. Blume)
Informationen
über Brennstoffzellen (Umweltbundesamt)
Alexander Kabza - Informationen
zum Thema Brennstoffzellen: www.pemfc.de
Schmidt-Walter, Heinz: Projekte
Brennstoffzellen und Brennstoffzellen in der Raumfahrt
Brennstoffzellen für
den Schulbedarf beziehen
Experimentiersets bei Lexsolar
(dort auch alkalische Brennstoffzelle), bei Conrad,
bei Cornelsen oder bei
Klüver &
Schulz
Brennstoffzellensets für
Schulen von h-tec
Kosmos Experimentierkasten
Brennstoffzelle bei
Amazon
Horizon Solar-Brennstoffzellen
bei
Amazon