| pH-Wert | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Alltag Mensch Boden Chemie pH-Wert im Alltag Jeder Aquarienfreund muss wissen, bei welchem pH-Wert sich die Fische wohlfühlen. Je nach Fisch-Art benötigt es einen ganz bestimmten pH-Wert, der eingehalten werden muss. Der pH-Wert gibt an, wie sauer oder alkalisch eine Lösung ist. Die Konzentration kann man auf einfache Weise mit einem pH-Testpapier messen. An einer Vergleichs-Skala lässt sich der pH-Wert ablesen: Zitronensaft
enthält zum Beispiel Citronensäure. Kernseife bildet mit
Wasser eine alkalische Lösung, die das Papier blau färbt.
Beim pH-Testpapier ist ein Farbstoff-Gemisch aufgetragen, das in
Abhängigkeit vom pH-Wert als Indikator wirkt. Wenn sich das Universalindikator-Papier rot verfärbt, ist eine Säure enthalten. Bei Laugen verfärbt
sich das Papier blau. Die Abstufung der Färbung kann in der pH-Skala dargestellt werden:
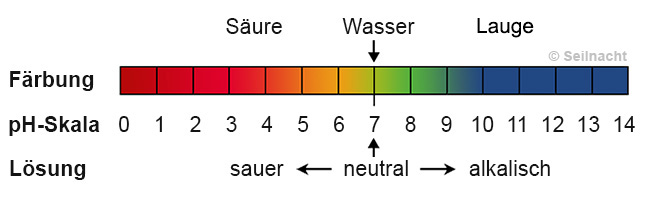
Der Ausgangspunkt der Skala ist reines Wasser, das bei 25 °C immer pH=7 besitzt, es reagiert neutral. Werte unterhalb zeigen Säuren an, Werte oberhalb Laugen oder Alkalien. Mit zunehmender Säure-Konzentration sinkt der pH-Wert einer Lösung, sie wird saurer. Mit zunehmender Laugen-Konzentration steigt der pH-Wert einer Lösung, sie wird alkalischer. Beim Wäschewaschen mit
Vollwaschmitteln ist eher ein hoher pH-Wert von pH=10 bis pH=11 notwendig,
damit die Tenside und die in den Waschmitteln enthaltenen Wirkstoffe voll zur Entfaltung kommen. Beim schonenden Waschen
mit Feinwaschmitteln ist der pH-Wert niedriger, dadurch sinkt aber auch
die Waschleistung. Wässrige Seifen-Lösungen wirken alkalisch, während
sich alkoholische Seifen-Lösungen neutral verhalten. Der pH-Indikator Phenolphthalein zeigt die alkalische
Wirkung der Seife im Wasser an:
pH-Wert im menschlichen Körper Im menschlichen Körper spielt der pH-Wert eine bedeutende Rolle. Im Blut steht der pH-Wert in unmittelbarem Zusammenhang mit dem Aufnahmevermögen des Sauerstoffs. Das Hämoglobin in den roten Blutkörperchen kann umso mehr Sauerstoff binden, je höher der pH-Wert ist. Das Blut ist ganz leicht alkalisch (=basisch): Der pH-Wert im Blut liegt beim gesunden Menschen zwischen pH=7,35 und pH=7,45. Der Mundspeichel ist mit pH=7,0 bis pH=7,1 neutral bis ganz leicht basisch. Das dort arbeitende Enzym Amylase spaltet die Stärke in kleinere Bausteine auf. Der Magensaft ist sehr sauer. Die jeweiligen Enzyme zur Verdauung funktionieren nur bei bestimmten pH-Werten. Das Pepsin im Magen benötigt etwa pH=2, damit es die Eiweiße aufspalten kann. Die Enzyme im Dünndarm arbeiten aber nur im neutralen bis leicht basischen Bereich. Der Bauchspeichel aus der Bauchspeicheldrüse enthält Natriumhydrogencarbonat, er besitzt einen pH-Wert von pH=8,0 und neutralisiert den sauren Verdauungsbrei aus dem Magen. Außerdem liefert er weitere Verdauungs-Enzyme für den Dünndarm, sowie Hormone. Die Galle mit pH=7,1 aus der Leber wird in der Gallenblase zwischengespeichert. Sie wird bei Nahrungsaufnahme ausgeschüttet und dient zur Fett-Verdauung im Zwölffingerdarm, dem ersten Abschnitt im Dünndarm. Dort liegt der optimale pH-Wert zwischen pH=6 und pH=8. Der Dickdarm mag es mit pH=5,5 bis pH=6,5 dagegen gerne wieder saurer. 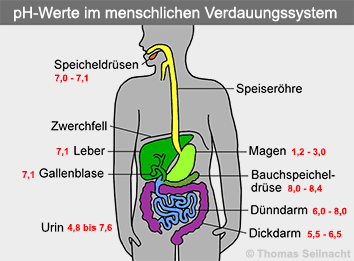 Das Verdauungssystem arbeitet mit mehreren Puffer-Systemen, die dazu dienen, überschüssige Säure aus dem Körper auszuscheiden. Aus diesem Grund ist der Urin (oder Harn) aus der Niere im Gegensatz zum Darm sauer. Im Urin befinden sich als saure Bestandteile Harnsäure, Oxalsäure oder Citronensäure. Er enthält auch Harnstoff, Kreatinin, Phosphate und andere Salze wie Natriumchlorid. Der normale pH-Wert im Urin liegt zwischen pH=4,8 und pH=7,6. Er schwankt im Tagesverlauf. Am Morgen ist der Urin infolge des Säure-Abbaus über Nacht saurer. Ist dies nicht der Fall, dann liegt eine Krankheit vor, bei der die Säure nicht abgebaut werden kann. Der pH-Wert im Urin ist auch von der Ernährung abhängig: Fleisch- und Milchprodukte führen zu einem niedrigeren pH-Wert im Urin, Gemüse und Obst erzeugen einen höheren pH-Wert. Sie werden als „basische Kost“ bezeichnet.  Harnsäure In den Zellen und in der Muskulatur liegt ein eher niedriger pH-Wert von pH=6,9 vor, weil bei der Verbrennung in den Zellen Kohlenstoffdioxid und Kohlensäure entstehen. Durch Bewegung und Sport findet eine schnellere Entsäuerung des Körpers statt.
Die Hautoberfläche des Menschen ist mit pH=5,5 relativ sauer. Dieser natürliche Säureschutzmantel der Haut hemmt das Wachstum von Bakterien und verhindert ihr Eindringen. Die normale Seife liegt mit pH=9 im alkalischen Bereich. Beim Waschen mit Seife wird daher die Säure auf der Haut neutralisiert. Die Haut ist dann einer höheren Infektionsgefahr ausgesetzt. Es benötigt nach jedem Waschen mit Seife zwei bis drei Stunden, bis der natürliche Säureschutzmantel wieder hergestellt ist. Aus diesem Grund sollte man Seife nur bei stark verschmutzten Händen einsetzen oder generell eine „pH-neutrale“ Seife verwenden. pH-Wert im Boden Der pH-Wert im Boden
beeinflusst den Nährstoffhaushalt der Pflanzen. Normalerweise stehen
Ammonium-Ionen und Nitrat-Ionen in den Böden bei pH=7 im Gleichgewicht.
In sauren Böden überwiegen die Ammonium-Ionen und in alkalischen
Böden die Nitrat-Ionen (>Stickstoffkreislauf). Bestimmte Pflanzen wie Fichten bilden Säure im Boden und senken den pH-Wert bis pH=5. Manche
Pflanzen wie das Torfmoos oder der Wald-Sauerklee lieben saure Böden. Ein
Buchenwald- oder Kalkboden ist mit pH=7 bis pH=7,8 fast neutral oder
leicht alkalisch. Dort wächst zum Beispiel der Huflattich gerne.
 Kalk kann Säure im Boden puffern, die bei der Bildung von Huminstoffen oder durch das Eintragen von saurem Regen entsteht. Die Pflanzen gedeihen in der Regel je nach
Anspruch bei einem pH-Wert zwischen 5 bis 7,8. Ein kalkarmer
Boden kann schneller ausgewaschen werden und neigt daher zur
Übersäuerung und zur Auswaschung von Nährstoffen. Ein
sehr
niedriger pH-Wert in den Böden oder in den Seen begünstigt das
Lösen von Metall-Ionen im Grundwasser. Dies kann Pflanzen oder den Wald erheblich schädigen.
Der pH-Wert ist eine Zahl, die angibt, wie hoch die Konzentration der Hydronium-Ionen [H3O+] in einer wässrigen Lösung ist. Sie wird durch den negativ dekadischen Logarithmus der H3O+-Ionen-Konzentration ausgedrückt: pH = − log [H3O+] Beispiel: In reinem Wasser
befinden sich immer 10−7mol/l der H3O+-Ionen
(und auch an OH−-Ionen). Dies ergibt sich aus dem Ionenprodukt
des Wassers. Wasser selbst wirkt also immer in geringem Umfang als Brönsted-Säure und als Brönsted-Base. Diese Eigenschaft wird als Autoprotolyse
des Wassers bezeichnet. Nun wird die Konzentration der H3O+-Ionen
im Wasser in die Gleichung zur Berechnung des pH-Werts eingesetzt: pH = − log [10−7] = −(−7) = 7 Dadurch ergibt sich ein
pH-Wert von 7 für Wasser. Der pOH-Wert gibt die Konzentration an OH−-Ionen
im Wasser an. Für alle Säuren und Laugen lassen sich demnach
immer ein pH-Wert und ein pOH-Wert berechnen. Die Summe der beiden Werte
ergibt immer 14: pH + pOH
= 14 Die Tabelle unten zeigt die Beziehung zwischen dem pH-Wert und dem pOH-Wert in Abhängigkeit von der vorliegenden Konzentration. Zwischen zwei pH-Werten, zum Beispiel zwischen pH=14 und pH=15, nimmt die Konzentration der Ionen um den Faktor Zehn ab oder zu. In alkalischen Lösungen übersteigt die Konzentration der Hydroxid-Ionen die der Hydronium-Ionen. In sauren Lösungen ist es umgekehrt. Moderne pH-Messgeräte
bestehen aus einer Elektrode und der Zentraleinheit. An der Elektrode wird
eine Spannung erzeugt, die vom pH-Wert abhängt. Die Zentraleinheit
rechnet die Spannung in den pH-Wert um.
Vor einer Messung muss
das Gerät kalibriert werden. Normalerweise führt dies im Labor
ein Laborant am Beginn jeden Tages einmal durch. Dazu werden zwei Pufferlösungen
mit unterschiedlichen pH-Werten verwendet. Zunächst misst man den
pH-Wert in der ersten Pufferlösung (pH=4). Dann spült man die
Elektrode mit destilliertem Wasser ab und misst den pH-Wert mit der zweiten
Pufferlösung (pH=7). Mit Hilfe einer Taste wird der angezeigte pH-Wert
korrigiert, bis er mit dem pH-Wert der Pufferlösungen übereinstimmt.
Es ist zu berücksichtigen, dass der angezeigte pH-Wert temperaturabhängig
ist. Für genaue Messungen arbeitet man daher mit exakt eingestellten
Wassertemperaturen.
Buch individuell erstellen: Basis-Text pH-Wert   > Inhaltsverzeichnis |