| Laugen – Basen | |||
Laugen im Haushalt
Laugen werden im Haushalt vor allem in Waschmitteln und Seifen eingesetzt. Sie fühlen sich seifig an. Abflussreiniger enthalten Natriumhydroxid, das beim Lösen in Wasser Natronlauge bildet. Diese löst vor allem Haare und Speisereste auf. Früher war in der Drogerie "Salmiaklösung" als Fensterputzmittel erhältlich, das verdünnte Ammoniaklösung enthielt. Diese entfernt auch hartnäckigen Schmutz wie Fett- oder Ölreste. Viele
Fensterputzmittel enthalten auch heute noch Ammoniaklösung. Der
Bäcker bestreicht die Brezel mit einer verdünnten
Natronlauge, bevor er sie bäckt. Dies führt nach dem Backen
der Brezel zu einem leicht bitteren Geschmack.
 Laugen als ätzende Stoffe Die ätzende Wirkung konzentrierter Laugen ist noch stärker als die der Säuren. Deshalb können Farb- und Lackreste an alten Schränken mit Laugen gut abgelaugt werden. Beim Arbeiten mit Laugen muss eine Schutzbrille getragen werden, auch Schutzhandschuhe sind notwendig. Die ätzende Wirkung der Laugen ist für den Menschen viel gefährlicher als die der Säuren, weil die menschliche Haut selbst eine Säure enthält und daher Säuren eher gewohnt ist. Schon ein Spritzer verdünnte Natronlauge im Auge kann zur Erblindung führen. Nachweis der Laugen
Laugen fühlen sich seifig an, der Geschmack ist bitter. Laugen wie Natronlauge dürfen aber keinesfalls berührt oder probiert werden. Der
Nachweis erfolgt mit einem Farbstoff oder einer Farbstofflösung,
die als pH-Indikator wirkt. Lackmus oder Thymolphthalein werden im Labor zum Beispiel dafür eingesetzt. Hält man einen
Streifen Universalindikatorpapier in eine Lauge, dann färbt sich
dieser blau. Damit wird angezeigt, dass eine alkalische Lösung vorliegt. Mit sauren Lösungen färbt sich der Streifen dagegen
rot. Zum Testen der Seife feuchtet man das Papier vorher an.
Der Laugen- und Basenbegriff in der Chemie 1. Alkalie oder Lauge als Stoff Der wahrscheinlich
erste Stoff in der Geschichte der Menschheit, der die Wirkung einer
Lauge zeigte, war die Asche, die bei der Verbrennung von
Holz und anderen Materialien aus Pflanzen entstand. Beim
Verbrennen von Holz entsteht zunächst die schwarze Holzkohle, die
unter Zufuhr des Luftsauerstoffs zu hellgrauer Asche verglüht.
 Wenn Holz verbrennt, entsteht zunächst Kohle, die zu hellgrauer Asche verglüht. Gibt man die Asche in Wasser, fühlt sich das Wasser danach leicht seifig an. Dass dabei eine alkalische Lösung oder eine Lauge entsteht, kann man mit einem pH-Indikator wie Phenolphthaleinlösung nachweisen. Diese färbt sich pink. Früher dampfte man eine Mischung aus Asche und Wasser in eisernen Pötten ein. So gewann man die Pottasche, die einen hohen Anteil Kaliumcarbonat enthielt. Die Pottasche konnte als Reinigungsmittel Öle und Fette auflösen, und sie diente beim Färben mit Pflanzenfarbstoffen zur Verstärkung der Farben auf dem Textilgewebe.  Holzasche wird in Wasser gegeben, das mit Phenolphthaleinlösung versetzt ist. Mit dem arabischen Wort kali wurden ursprünglich die Asche liefernden Pflanzen bezeichnet. Später übertrug man den Begriff auf die Pottasche, die bei den Arabern al-qalya hieß. Der Alchemist Raimundus Lullus unterschied den Salpeter (Kaliumnitrat) vom Alkali. Damit meinte er die Pottasche und auch das Soda, er konnte die beiden Stoffe noch nicht unterscheiden. Die Alchemisten erkannten noch kein besonderes Prinzip in den Alkalien. Die erste Unterscheidung einer Alkalie als Gegenpol zu einer Säure fand in der Chemiatrie statt, einem medizinischen Therapiekonzept des Apothekers Otto Tachenius (1610-1680), das auf Paracelsus zurückging.  Kaliumcarbonat bezeichnete man früher als Pottasche. Die Chemiker erkannten erst allmählich,
dass die Alkalien besondere Merkmale aufweisen. Sie sind löslich
in Wasser und sie besitzen eine "Kaustizität": Darunter verstand
man früher die Ätzwirkung eines Stoffs. Der Begriff leitet
sich vom lateinischen Wort causticus (brennend) ab. Auch das Wort ätzend leitet sich davon ab. Wer als erster den Begriff einer Lauge verwendete, ist
nicht mehr bekannt. Wahrscheinlich wurde er allmählich als Synonym
für die Alkalien eingesetzt, weil diese andere Stoffe "laugen" können. Das Wort laugen verwendete man früher zum Waschen der Wäsche. Mit dem altnorddeutschen Wort laug und auch mit dem westgermanischen laugo bezeichnete man früher ein warmes Bad.
 Eine wässrige Soda-Lösung war lange Zeit die bedeutendste Wasch-Lauge. Bei der Reaktion mit Säuren verlieren die Alkalien ihre Ätzwirkung, und sie bilden dabei Salze. Heute würde man das Phänomen mit einer Neutralisation erklären. Der Begriff "Base" wurde im 18. Jahrhundert erstmals verwendet, da die wässrigen Lösungen von Natriumhydroxid oder Natriumcarbonat als "Basis" für die Salzbildung galten. Gibt man zum Beispiel verdünnte Salzsäure auf Soda oder in eine wässrige Soda-Lösung, entstehen Natriumchlorid, Kohlenstoffdioxid und Wasser: Natriumcarbonat + Salzsäure Na2CO3 + 2 HCl  Verdünnte Salzsäure reagiert mit Natriumcarbonat unter Aufschäumen. Heute bezeichnet man eine Lösung, die alkalisch reagiert und Hydroxid-Ionen enthält, als Lauge. Wässrige Lösungen reagieren alkalisch, wenn ihr pH-Wert größer als 7 ist. Die Konzentration der Hydroxid-Ionen übersteigt die der Hydronium-Ionen. Alkalische Lösungen mit Hydroxid-Ionen entstehen zum Beispiel, wenn Metalle, Metalloxide oder -hydroxide mit Wasser reagieren. Besonders die Alkalimetalle und Erdalkalimetalle, sowie ihre Oxide und Hydroxide reagieren gerne mit Wasser unter Bildung von Hydroxid-Ionen: Natrium + Wasser 2 Na + 2 H2O Calciumoxid + Wasser CaO + H2O Calciumhydroxid + Wasser Ca(OH)2 + H2O  Natrium reagiert mit Wasser, dem zuvor Phenolphthalein zugesetzt wurde. 2. Basenbegriff nach Arrhenius Gelegentlich wurden die Begriffe Lauge und Base synonym verwendet, dies ist aber nach heutigem Verständnis irreführend. Der schwedische Chemiker Svante Arrhenius definierte um 1887 die Basen als Stoffe, die im Wasser Hydroxid-Ionen OH- und ein Baserest-Ion bilden. Natriumhydroxid NaOH wäre nach Arrhenius eine Base. Nach Arrhenius' Basenbegriff enthalten alkalische Lösungen negativ geladene Hydroxid-Ionen und positiv geladene Baserest-Ionen: 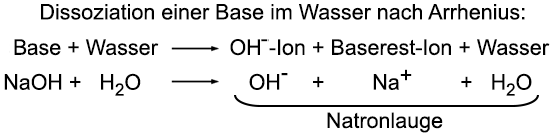 Die Einführung des Basenbegriffs war notwendig geworden, weil die beim Auflösen von Natriumhydroxid in Wasser entstehende Natronlauge nach der Arrhenius-Definition keine Base ist. Trotzdem war Arrhenius' Basenbegriff zu wenig präzise, da es neben den Hydroxiden auch andere Stoffe gibt, die alkalische Lösungen bilden können. Dies erforderte eine neue Definition des Basenbegriffs. 3. Funktioneller Basenbegriff nach Brönsted Der dänische Chemiker Johannes Brönsted
(1879-1947) führte eine neue Basen-Definition ein: Brönsted-Basen sind Protonen-Empfänger oder Protonen-Akzeptoren. Das folgende Beispiel zeigt,
was passiert, wenn sich die Brönsted-Base Ammoniak im Wasser löst. Das Ammoniak erhält vom Wasser-Molekül
ein Proton übertragen und wird zu einem positiv geladenem
Ammonium-Kation NH4+.
Übrig bleibt ein Hydroxid-Anion OH−. 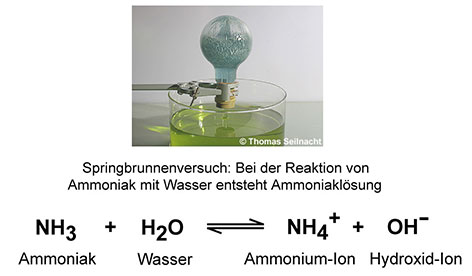 Die Brönsted-Base ist das Ammoniak-Molekül, das als Protonen-Akzeptor wirkt. Die Brönsted-Säure ist das Gegenteil der Brönsted-Base. Brönsted-Säuren
übertragen Protonen, sie wirken als Protonen-Donatoren. Daher wirkt
das Wasser beim Einleiten von Ammoniak als Brönsted-Säure.
Beim Lösen von Natriumhydroxid in Wasser war nach Arrhenius das Natriumhydroxid eine Base, weil sie Hydroxid-Ionen im Wasser bildet. Nach heutigem Verständnis ist diese Reaktion lediglich eine Dissoziation des Salzes im Wasser. Nach Brönsted wirkt der Stoff Natriumhydroxid beim Auflösen in Wasser nicht als Base. Das Hydroxid-Ion kann nur als Base wirken, wenn es wie bei der Neutralisation der Natronlauge mit Salzsäure Protonen aufnimmt. Ein Carbonat-Ion kann auch als Base wirken: Löst man zum Beispiel Natriumcarbonat im Wasser, entsteht unter Wärmeentwicklung eine stark alkalische Lösung. Das Carbonat-Ion reagiert dabei als Brönsted-Base mit einem Wasser-Molekül zu einem Hydrogencarbonat-Ion und einem Hydroxid-Ion: CO3 2− + H2O  Ein angefeuchtetes Universalindikator-Papier färbt sich mit Natriumcarbonat blau. Weitere Informationen
Ätzende Stoffe bei den Gefahrstoffen Laugen in der Chemikaliendatenbank Powerpoint-Präsentationen zum Thema Brönsted-Säuren Säure-Base-Begriff nach Lewis Buch individuell erstellen: Basis-Text Laugen, Basen   > Inhaltsverzeichnis |
