|
Gase werden im Labor in vielfältiger Art und Weise benötigt. Zur Herstellung von Gasen in der Schule kommen verschiedene Verfahren in Betracht. Für einfache Schülerübungen erfüllen schwer schmelzbare Reagenzgläser, die mit einem Stopfen und einem Ableitungsrohr verbunden sind, ihren Zweck.
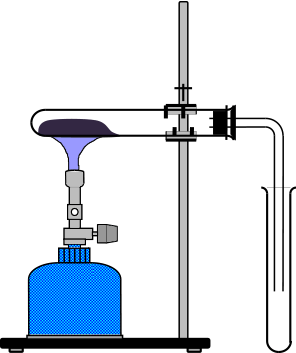
Thermische Zersetzung von festen Stoffen Das Reagenzglas wird waagerecht in ein Stativ gespannt und vorsichtig erhitzt. Da Sauerstoff
schwerer als Luft ist, wird er in ein senkrecht stehendes Reagenzglas,
dessen Öffnung nach oben zeigt, eingeleitet. Auf diese Art und Weise
kann durch das Erhitzen von Kaliumpermanganat auf über 240 °C Sauerstoff hergestellt werden (>Schülerübung):
10 KMnO4
Austreiben von Gasen aus Flüssigkeiten durch Erhitzen
Sind Gase in Flüssigkeiten gelöst, können Sie durch einfaches Erhitzen ausgetrieben werden. Man verwendet in der Regel zwei Rundkolben aus Duranglas, wobei auf den unteren Kolben ein Stopfen mit Gasableitungsrohr aufgesetzt wird. Durch vorsichtiges Erhitzen füllt sich der obere, umgekehrte Rundkolben mit dem ausgetriebenen Gas. Diese Apparatur eignet sich beispielsweise zur Herstellung von Chlorwasserstoff oder von Ammoniak für Springbrunnen-Versuche: 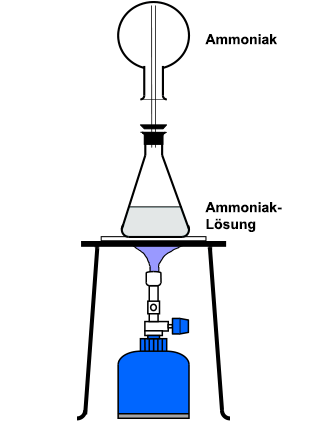 Der Nachteil dieser Methode liegt in dem hohen Feuchtigkeitsgehalt der ausgetriebenen Gase. Sie müssen daher gegebenenfalls getrocknet werden (>Trocknen von Gasen). Für Schülerübungen eignen sich auch zwei starkwandige, aufeinander gestellte Reagenzgläser, wobei das untere im Wasserbad erhitzt wird. Dabei ist allerdings zu beachten, dass Schüler mit konzentrierten Säuren nicht arbeiten dürfen.
Gasentwicklung durch chemische Reaktion mit einer Flüssigkeit
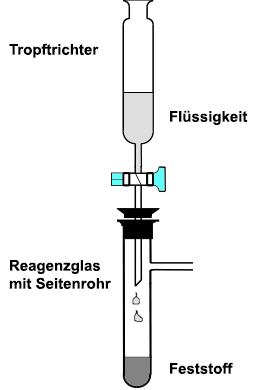
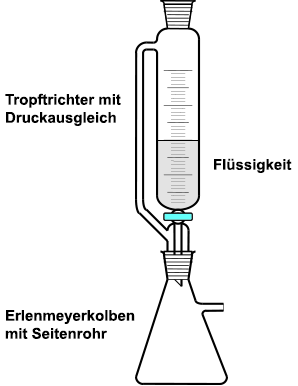
Ein einfacher, ungeregelter Gasentwickler besteht aus einem Reaktionsbehälter, zum Beispiel einem Rundkolben oder einem Erlenmeyerkolben mit Ableitung und einem aufgesetzten Tropftrichter. Über den Hahn lässt sich die zugeführte Menge Flüssigkeit in den Reaktionsbehälter regeln. Eine Unterbrechung durch Verschluss der Ableitung ist nicht möglich, da dann der Behälter platzen würde, sofern es keinen Druckausgleich besitzt.
Werden giftige oder aggressive
Gase wie Chlor hergestellt, ist in
jedem Fall eine Schliffapparatur zu verwenden. Außerdem sollte die
Gasentwicklung im gut ziehenden Abzug durchgeführt werden. Die Tropfgeschwindigkeit
und damit auch die Geschwindigkeit der Gasentwicklung kann mit dem Hahn
am Gasentwickler gesteuert werden.
Die Geschwindigkeit der Gasentwicklung hängt von mehreren Faktoren ab, unter anderem auch von der Reaktionsgeschwindigkeit. Wasserstoff lässt sich auch durch das Hineinwerfen von gekörntem Calcium in Wasser leicht herstellen. Dabei entsteht unter Wasserstoffbildung Calciumhydroxid (>Schülerübung):
Ca + 2 H2O Das bekannteste Gerät zur kontinuierlichen Gasentwicklung ist der von dem Apotheker Petrus Jacobus Kipp (1808–1864) im Jahre 1860 erfundene Kipp'sche Gasentwickler. Dieser arbeitet nach folgendem Prinzip: a) Nach dem Einfüllen des Feststoffes (zum Beispiel Zink granuliert) und der Flüssigkeit (zum Beispiel Salzsäure) bei geschlossenem Hahn, steigt die Flüssigkeit im unteren Behälter solange, bis die darüber stehende Luft ein weiteres Ansteigen verhindert. b) Durch das Öffnen des Hahns entweicht zunächst Luft, so dass die Flüssigkeit wieder ansteigt und in den mittleren Behälter gelangt. Dadurch reagiert die Flüssigkeit mit dem Feststoff und es entsteht ein Gas (zum Beispiel Wasserstoff). c) Beim Schließen des Hahns wird die Flüssigkeit durch das zunächst noch entstehende Gas zurückgedrängt, so dass die Gasentwicklung wieder stoppt. 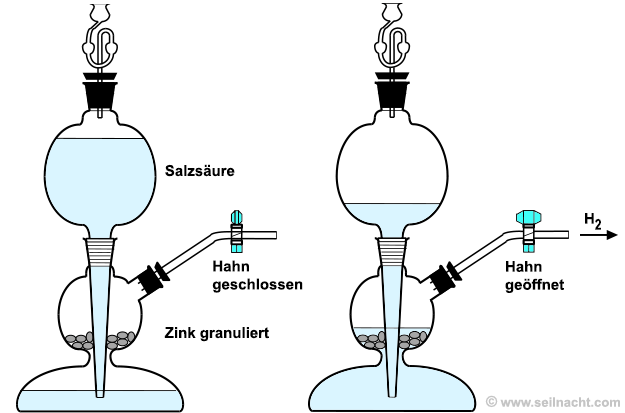
Kipp'scher Gasentwickler zur kontinuierlichen Entnahme von Wasserstoff
Beim Arbeiten mit einem Kipp'schen Gasentwickler sind einige Überlegungen zur Sicherheit zu beachten.
So sollten die Stopfen mit Schliff-Fett gefettet und mit Drahtschellen gesichert
sein, damit sie durch das entstehende Gas nicht herausgedrückt werden.
Bei der Herstellung von Wasserstoff muss die Knallgasprobe durchgeführt
werden, bevor das Gas entzündet wird.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Weitere Informationen Gase auffangen und messen: Volumenbestimmung von Gasen Beseitigen von Feuchtigkeit: Trocknen von Gasen Gasreinigung: Adsorbieren oder Absorbieren Informationen zu den Laborgasen, Bedienen von Flaschen, Toxikologie: Lexikon der Gase |