|
Aussehen farblose, sirupartige Flüssigkeit Vorkommen Milch, Früchte, tier. Organe |
Molmasse 90,078 g/mol AGW keine Angaben Dichte 1,2060 g/cm3 Schmelzpunkt +16,9 °C Siedepunkt +122 °C Wasserlöslichkeit vollst. mischbar Flammpunkt +110 °C |
||||
| Piktogramme GHS 05 Gefahr |
Gefahrenklassen
+ Kategorie Ätz-/Reizwirkung auf die Haut 1 C Schwere Augenschädigung 1 |
HP-Sätze (siehe auch Hinweis) H 314 P 280.1-3, 302+352, 305+351+338, 310 Entsorgung G 1 |
||||
| Etikett drucken | Dt. Bezeichnung Synonyme (deutsch) |
Engl. Bezeichnung Synonyme (engl.) |
||||
| CAS 598-82-3 | DL-Milchsäure 2-Hydroxypropansäure |
DL-Lactic acid 2-Hydroxypropanoic acid |
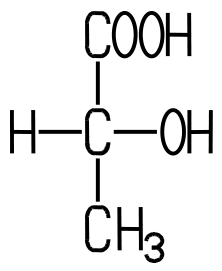
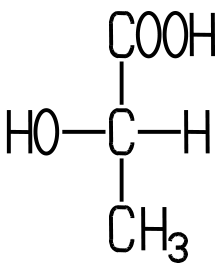
| Eigenschaften Die in saurer Milch weit
verbreitete DL-Milchsäure enthält zwei Enantiomere mit Spiegelbild-Isomerie. Die saure Milch enthält daher ein
Racemat, ein Gemisch zweier Enantiomere. Bei der DL-Milchsäure handelt
sich um eine klare, sirupartige, geruchlose und angenehm sauer schmeckende
Flüssigkeit, die in Wasser, Ethylalkohol und Aceton gut löslich
ist. Auf Haut und Augen wirkt sie ätzend.
Während die linksdrehende
D(-)-Milchsäure vorwiegend beim mikrobiologischen Abbau von Traubenzucker
entsteht, kommt die rechtsdrehende L(+)-Milchsäure im Blut, in der
Muskulatur und in den Organen der Tiere und Menschen vor. Die Schmelztemperaturen
von links- und rechtsdrehender Milchsäure liegen bei 25 °C, die
des Racemats bei 17 °C. Unterhalb der Schmelztemperatur bilden sich
farblose, leicht zerfließliche Kristalle. Die Salze der Milchsäure
heißen Lactate. Beim längeren Stehen von Milch findet eine rasche Vermehrung der Milchsäurebakterien statt. Die optimale Temperatur dafür liegt bei 37 °C. Die Bakterien zerlegen den Milchzucker in Milchsäure. Der pH-Wert sinkt auf Werte unter pH=5. Die entstehende Säure lässt das Milcheiweiß Casein gerinnen, das dann aus der Milch ausflockt. Außerdem hemmt die Säure das Wachstum von anaeroben Bakterien. Auf diese Weise können Lebensmittel haltbar gemacht werden. Sauerkraut und milchsauer vergorene Gurken und Bohnen sind Beispiele dafür. |
| Herstellung Die Herstellung erfolgt
nach dem Prinzip der milchsauren
Vergärung. In der Technik werden Kohlenhydrate – meist Kartoffel-
oder Getreidestärke – mit Hilfe des Enzyms Diastase zu Maltose umgewandelt. Durch die Zugabe von Milchsäure-Bakterienkulturen, zum Beispiel Lactobazillus delbrueckii, vergärt die Maltose bei 37 °C
über Glucose als Zwischenprodukt in vielen,
komplizierten Schritten zur DL-Milchsäure. Da die Milchsäurebakterien
im sauren Medium ihre Tätigkeit einstellen, wird die entstehende Milchsäure
durch die kontinuierliche Zugabe von Calciumcarbonat als Calciumlactat ausgefällt. Mit Schwefelsäure lässt sich dann wieder Milchsäure gewinnen. Der Gärungsvorgang
entspricht in weiten Teilen der Glycolyse, dem Zuckerabbau im menschlichen
Stoffwechsel. Verwendet man spezielle Bakterienkulturen, lassen sich auch
reine Formen von links- oder rechtsdrehender Milchsäure gewinnen. |
| Verwendung Die Lebensmittelindustrie
benötigt Milchsäure zur milchsauren Vergärung, als Konservierungsstoff
und als Säuerungsmittel (E 270), als Zusatz für alkoholfreie
Getränke und zur Fabrikation von Sirup und Brauselimonaden. In der
Medizin wird sie als verdauungsförderndes Mittel bei Kleinkindern
eingesetzt. Die Gerberei verwendet die Milchsäure zum Entkalken von
Fellen. In der chemischen Industrie dient sie zur Herstellung von Lactaten.
|