 |
Gefahrenhinweise:
Konzentrierte Essigsäure und seine Dämpfe reizen Haut
und Atemwege
|
|
|
 |
Gefahrenhinweise:
Konzentrierte Essigsäure und seine Dämpfe reizen Haut
und Atemwege
|
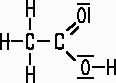 |
Eigenschaften:
Reine, 100%ige Essigsäure ist bei Zimmertemperatur eine klare, farblose, stark nach Essig riechende Flüssigkeit. Schon bei 17°C erstarrt sie zu einer eisähnlichen Masse, die als Eisessig bezeichnet wird. Die reine Essigsäure färbt Indikatorlösungen nicht, erst wenn sie mit Wasser verdünnt wird, können sich wie bei der Salzsäure H3O+-Ionen bilden. Trotz der ätzenden Wirkung der reinen Säure ist sie eher eine schwache Säure. |
Vorkommen:
Essigsäure kommt in vielen Pflanzensäften und in Etherischen
Ölen vor. Steht Wein für mehrere Wochen an der Luft, entsteht
durch eine Oxidation aus dem Alkohol des Weins Essigsäure, der Wein
wird sauer. Dieses Verfahren wurde bereits in der Antike angewandt.
Herstellung :
Neben der Essigsäuregärung aus Alkohol
kann sie auch durch eine trockene Destillation von Holz bei ca. 350°C
gewonnen werden. Im Destillat befinden sich etwa 82% Wasser, 7% gelösten
Teer und 8-10% Säuren, die vorwiegend aus Essigsäure bestehen.
Verwendung:
Speiseessig enthält etwa 5% Essigsäure, Essigessenz bis zu
25% Säure. Mit Essigessenz können Kalkablagerungen gelöst
werden. Sie wirkt stark keimtötend und wird deshalb als Lebensmittel-Zusatzstoff
zum Konservieren von Speisen verwendet (E 260). In der chemischen Industrie
ist Essigsäure ein wichtiges Zwischenprodukt zur Herstellung von Kunstfasern,
Kunststoffen, Riechstoffen und Medikamenten.
Andere Internet-Seiten:
Chemikaliensteckbrief Essigsäure
Essigsäure
als Gefahrstoff im ICSC