|
Weißes Pulver |
Molmasse
56,077 g/mol
AGW 1 mg/m3 E (TRGS 900) Schmelzpunkt +2613°C Dichte 3,34 g/cm3 Wasserlöslichkeit (alkalisch) setzt sich zu Calciumhydroxid um |
| Piktogramme
GHS 05 GHS 07 Gefahr |
Gefahrenklassen
+ Kategorie
Schwere Augenschädigung 1 Reizwirkung auf die Haut 2 Spez. Zielorgan-Toxizität einmal. 3 |
HP-Sätze
(siehe auch Hinweis)
H 315, 318, 335 P 261, 280.1-3, 305+351+338 Entsorgung G 4 |
| Etikett drucken | Deutscher Name | Englischer Name |
| CAS 1305-78-8 | Calciumoxid | Calcium oxide |
| Eigenschaften
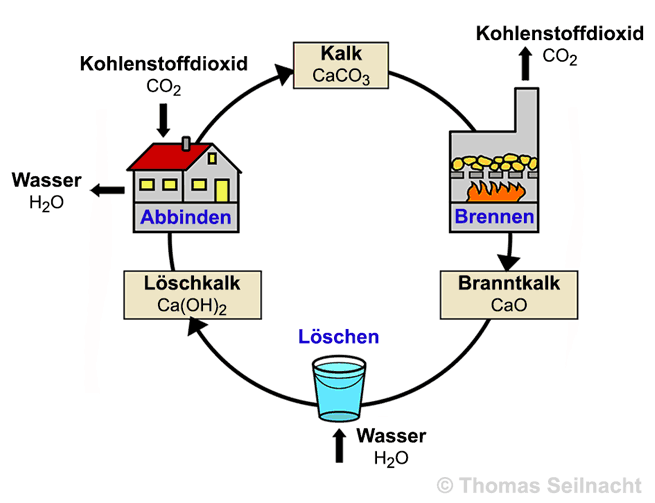
Calciumoxid wird unter dem Namen „Branntkalk“ oder „gebrannter Kalk“ in unreiner Form gehandelt. Es setzt
sich mit Wasser unter starker Wärmeentwicklung zu Calciumhydroxid
um. Bei jeder Wasserzugabe zu Calciumoxid entsteht Kalkwasser, das alkalisch reagiert.
CaO + H2O Ca(OH)2 + H2O Aufgrund dieser
Reaktion, die natürlich sofort auch mit
Körperflüssigkeiten stattfindet, ist Calciumoxid als
Gefahrstoff gleich eingestuft wie Calciumhydroxid. Eine heftige
Reaktion kann auch bei der Zugabe von Säuren, von Glycerin
und von einer Zuckerlösung beobachtet werden. In Ethanol ist Calciumoxid
nicht löslich. Aus der Luft zieht es Wasser und Kohlenstoffdioxid
an, so dass es allmählich in Calciumcarbonat
zerfällt.
 Calciumoxid reagiert unter Wärmeentwicklung mit Wasser. |
| Herstellung
Branntkalk wird durch
Erhitzen von Calciumcarbonat auf über
1000 °C hergestellt. Im Labor kann er auch durch das Verbrennen von Calcium
erhalten werden:
2 Ca + O2
|
| Verwendung
Der größte
Anteil Calciumoxid wird zur Mörtelherstellung benötigt. Es dient auch als Rohstoff zur industriellen
Herstellung von künstlichen Kalksandsteinen.
Calciumoxid ist als Lebensmittelzusatzstoff E 526 zugelassen und fungiert
dort als Säureregulator. Im Labor eignet es sich als Trocknungsmittel
für Stoffe und als Absorptionsmittel
für Kohlenstoffdioxid. Da Calciumoxid mit
Wasser zu Calciumhydroxid reagiert, kann es
für die Zubereitung von Kalkwasser verwendet werden. Die chemische
Industrie benötigt es zur Herstellung anderer Calciumverbindungen
wie Calciumcarbid oder Chlorkalk. Bei der Metallgewinnung
wird es als Flotationshilfsmittel eingesetzt. Calciumoxid wird auch in
der Glas-, Papier-, Soda- und Zuckerfabrikation benötigt.
Alter Kalkofen bei Marchtal im Allgäu |