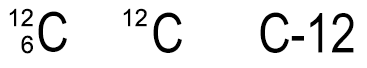Atome als Bausteine des Universums
Atome stellen die Aufbausteine
für die Vielfalt der chemischen Verbindungen, der Salze, der Moleküle
und für die gesamte Welt der Stoffe dar. Reines Gold ist zum Beispiel nur aus Gold-Atomen aufgebaut. Da noch niemand
Gold-Atome gesehen hat, werden für die Atome Symbole eingeführt. Die
Atome selbst wiederum sind aus ihren Komponenten, den Elementarteilchen,
aufgebaut, und diese wiederum aus den Quarks. Neben den drei Elementarteilchen
Protonen, Neutronen und Elektronen sind weitere bekannt, die aber am Aufbau eines Atoms im Hinblick auf die
Masse keine wesentliche Rolle spielen. Die Protonen und Neutronen im Atomkern werden als Nukleonen bezeichnet. Die Summe aller Nukleonen in einem Atom ergibt die Nukleonenzahl.
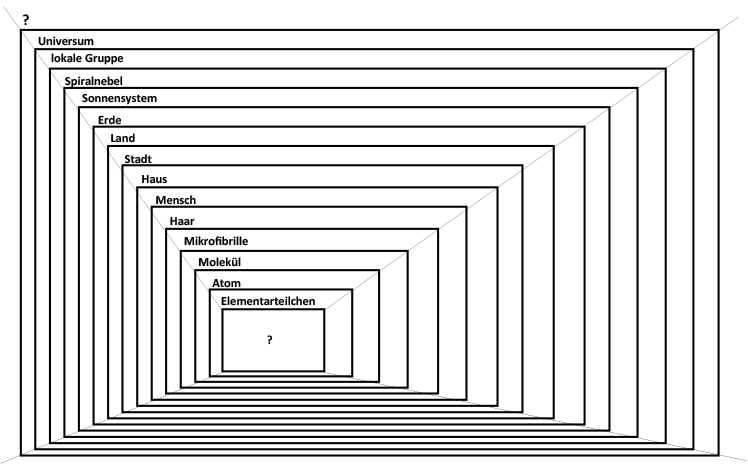
Es kann jede System-Ebene – der Stoff, das Atom und das Elementarteilchen – als eigenständiges System
betrachtet werden. Dieses Prinzip lässt sich auch in der sichtbaren Welt bis zum
Universum fortführen. Die Elementarteilchen bauen die Atome, die Atome die Moleküle,
die Moleküle die Zellen auf, usw.:
 Ein Atom hat nur
sehr
wenige Eigenschaften, die mit den Begriffen aus der
Erfahrungswelt beschrieben
werden können. Es ist zählbar, hat Masse,
Raumsymmetrie (aber nicht Volumen!) Energie und Komposition. Die
Eigenschaften eines Stoffes ist nicht
reduzierbar auf dessen Komponenten: Gold-Atome haben keine
Farbe. Erst eine bestimmte Art des Zusammenspiels
von Komponenten und Kräften im System erzeugen den
Glanz und den Farbeindruck goldgelb.
Im Periodensystem sind die elementaren Atome in aufsteigender Reihenfolge nach der Zahl der Protonen in ihren Atomen geordnet. 1 Wasserstoff-Atom hat
1 Proton (Wasserstoff: Ordnungszahl 1)
Die positive Ladung der Protonen im
Atomkern wird durch die negative Ladung der Elektronen ausgeglichen. Das
Element Nr. 1, Wasserstoff besitzt immer 1 Proton und 1 Elektron, es
gilt:
Ordnungszahl = Protonenzahl = Kernladungszahl = Elektronenzahl = Elementnummer im PSE
Ein C-Atom besitzt 6 Protonen und 6 Neutronen im Atomkern und 6 Elektronen in der Atomhülle. Die Nukleonenzahl beträgt 12. Häufig wird die Nukleonenzahl über die Protonenzahl links neben das einzelne Elementsymbol geschrieben. Diese Schreibweise empfiehlt sich aber auf keinen Fall für das Periodensystem, weil die Nukleonenzahl sonst mit der relativen Atommasse verwechselt werden kann.
Bei der Schreibweise für die Isotope
wird die Zahl links unten oft auch weggelassen. Man kann auch einfach
nur C-12 mit einem Bindestrich schreiben. Da die Elektronen im Vergleich
zu den Kernteilchen eine verschwindend geringe Masse
besitzen, spielen sie in der Gesamtmasse praktisch keine Rolle. Es gilt:
Neutronenzahl = Massenzahl
− Protonenzahl
Die elementaren Atome im Periodensystem sind mit steigender Ordnungszahl von links nach rechts in mehreren Perioden angeordnet. Da die Ordnungszahl der Protonenzahl und der Elektronenzahl entspricht, kann man auch sagen, dass die elementaren Atome mit steigender Protonen- oder Elektronenzahl angeordnet sind. Die Entwicklung des Atombegriffs
Die Theorien zu den einzelnen
Atomvorstellungen werden bei den Portraits über die entsprechenden
Forscher oder bei den verlinkten Begriffen genauer ausgeführt.
Literaturhinweis Buck/Rehm/Seilnacht: Der Sprung zu den Atomen
Buch individuell erstellen: Basis-Text Atombegriff   > Inhaltsverzeichnis |