|
Das Orbitalmodell
 Ionisierungsenergie Mit der Ordnungszahl steigen
tendenziell, aber nicht regelmäßig, die Atomradien der Elemente.
Der Atomradius ist eine aus den Abständen zwischen den Atomkernen
und den Elektronen abgeleitete Größe, die allerdings nur bedingt über die
tatsächliche Größe eines Atoms Aufschluss gibt. Interessanter
erscheinen die Gesetzmäßigkeiten im Hinblick auf die Ionisierungsenergie:
Darunter versteht man die Energie, die man aufwenden muss, um ein Elektron
ganz aus dem Atom zu entfernen. Bei den Edelgasen
lassen sich die Elektronen nur schwer entfernen. Es muss sehr viel Energie
aufgewendet werden. Die Alkalimetalle
können ihr einzelnes Valenzelektron leicht abgegeben, die aufgewendete
Ionisierungsenergie dafür ist relativ gering. Die aufgewendete Energie
zur Ablösung des 2. Elektrons nennt man 2. Ionisierungsenergie, beim
3. Elektron 3. Ionisierungsenergie:
Bei Elementen mit steigender Ordnungszahl wird weniger Energie zur Ablösung der Elektronen benötigt, weil die Atomradien zunehmen und die äußersten Elektronen aufgrund des steigenden Abstandes vom Atomkern nicht mehr so stark vom Kern angezogen werden. Verteilung der Elektronen in Orbitalen nach Energieniveaus Ein Orbital beschreibt den wahrscheinlichen Aufenthaltsbereich von Elektronen. Ein Orbital kann mit höchstens zwei Elektronen besetzt sein. Das Orbital wird durch den Kasten, die Elektronen werden durch die Pfeile dargestellt. Jedem Orbital sind nach dem Pauli-Prinzip zwei Elektronen zugeordnet, die sich im Hinblick auf ihre Spinquantenzahl unterscheiden. Dies wird durch die unterschiedliche Richtung der Pfeile angedeutet. Die Orbitale werden nach ihrem Energieniveau unterschieden. Sind beispielsweise drei Orbitale auf dem gleichen Energieniveau, dann nennt man sie p-Orbitale:
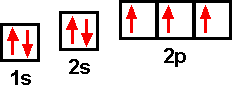
Die Orbitale innerhalb eines Energieniveaus werden nach der Hundschen Regel normalerweise der Reihe nach zuerst nur einfach besetzt, erst dann erfolgt eine Doppelbelegung. Beim Stickstoff-Atom (7 Elektronen) sind beispielsweise die 2p-Orbitale jeweils mit nur einem Elektron besetzt:  Stickstoff-Atom Stickstoff-AtomStehen die Energieniveaus verschiedener Orbitale sehr nahe beieinander, dann kann die Besetzung auch atypisch erfolgen, beispielsweise bei den Übergangselementen, den Lanthanoiden und den Actinoiden. Verteilung der Elektronen in Schalen Die Elektronen eines Atoms werden im Schalenmodell verschiedenen Schalen zugeordnet, die unterschiedliche Energieniveaus darstellen:
Im Schalenmodell bezeichnet man das energetisch höchste besetzte Energieniveau als Valenzschale (manchmal etwas irreführend „äußerste Schale" genannt). Diese ist für chemische Bindungen maßgebend, da die dort befindlichen Elektronen an Bindungen teilnehmen können (ausgenommen sind Edelgas-Atome, bei denen dieses Energieniveau vollständig besetzt ist). Die Valenzschale des Stickstoff-Atoms enthält beispielsweise fünf Elektronen. Diese Elektronen nennt man Valenzelektronen.  Die Elektronen der Valenzschale sind für chemische Bindungen maßgebend, beispielsweise bei der Elektronenpaarbindung. Bei den IUPAC-Gruppen 1 und 2, sowie 13 bis 18 (Hauptgruppen I bis VIII) gilt: Atome, bei denen die Valenzschale gleichartig besetzt ist, stehen im Periodensystem untereinander in einer Gruppe. Dies begründet die ähnlichen chemischen Eigenschaften der Elemente, die untereinander stehen. Weitere Infos Das Schalenmodell als vereinfachtes didaktisches Modell (Powerpointpräsentation) |