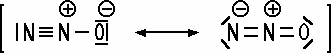 |
Farbloses Gas mit süßlichem Geruch |
Molmasse
44,012 g/mol AGW 100 ml/m3 oder 180 mg/m3 (TRGS 900) Dichte 1,9781 g/l (Gas, 0 °C, 1013 hPa) (Lachgas : Luft = 1,53) Schmelzpunkt −90,8 °C Siedepunkt −88,48 °C Wasserlöslichkeit Konz. bei 20 °C 1,2 g/l |
| Piktogramme GHS 03 GHS 04 GHS 07 Gefahr |
Gefahrenklassen
+ Kategorie Oxidierende Gase 1 Gase unter Druck, verdicht. Gas Spezifische Zielorgantoxizität einmalig 3 |
HP-Sätze (siehe Hinweis) H 270, 280, 336 P 220, 244, 280.3, 370+376, 410+403 Entsorgung besondere Hinweise |
| Deutsche Bezeichnung Synonyme (dt.) |
Engl. Bezeichnung Synonyme (engl.) |
|
| CAS 10024-97-2 | Lachgas Distickstoffoxid |
Laughing gas Nitrous oxide |
| Wirkung auf den menschlichen Körper Durch das Einatmen von
Lachgas können krampfartiges Lachen, Halluzinationen und Rauschzustände
ausgelöst werden. Es wirkt in geringen Konzentrationen narkotisch
und ist daher heute eines der am meisten benutzten Gase bei leichteren,
operativen Eingriffen, bei denen eine Narkose notwendig ist. Es wird meist
zusammen mit reinem Sauerstoff oder in Kombination mit anderen Narkosemitteln
verabreicht, die Wirkung tritt sehr schnell ein. Bei hohen Dosierungen
kann ein Vitamin-B12-Mangel auftreten. |
| Eigenschaften Lachgas besitzt einen
schwach süßlichen Geruch. Es löst sich nur wenig in Wasser,
besser dagegen in Schwefelsäure, Ethylalkohol und Diethylether. Lachgas
unterhält die Verbrennung. Eine Kerzenflamme brennt in Lachgas heller
als in Luft. Es ist 1,5 Mal schwerer als Luft und ist unter Normalbedingungen
sehr beständig. Oberhalb von 300° Celsius zerfällt es in Stickstoff und Sauerstoff:
N2O Brennbare Stoffe und
vor allem brennbare Gase reagieren mit Lachgas fast so heftig wie mit reinem
Sauerstoff, da dieser während dem Verbrennungsvorgang gebildet wird.
Mit verdampftem Schwefelkohlenstoff CS2 entsteht nach der
Zündung ein blauer Lichtblitz mit verdampftem
Ethanol oder Methanol reagiert es ebenfalls heftig. Dabei werden neben
dem Schwefel die Gase Stickstoff, Kohlenstoffmonooxid und Schwefeldioxid gebildet:
3 N2O + CS2
Mit Wasserstoff bilden
sich Knallgasgemische, die beim Zünden mit hohem, pfeifendem Ton explodieren.
Dabei entstehen Stickstoff und Wasser:
N2O + H2 Mesomerie beim Lachgas-Molekül Das Lachgas-Molekül lässt sich in einer Strukturformel nur als mesomeres System darstellen. Die Bindungselektronen sind nicht eindeutig zugeordnet:
|
| Herstellung Die erstmalige Herstellung
gelang dem Engländer John Priestley (1733–1804) im Jahre 1773 durch die Einwirkung von Stickstoffmonooxid auf
Eisenfeilspäne. Humphry Davy (1778–1829) untersuchte die berauschende Wirkung des Gases im Eigenversuch
und schlug 1799 die Verwendung als Narkotikum vor. Aber erst 1868 wurde
ein Gemisch aus Lachgas und Sauerstoff in der Medizin dafür verwendet. Die heutige technische
Herstellung erfolgt durch die Zersetzung von Ammoniumnitrat unter Hitze. Zuerst bildet sich dabei Ammoniak und Salpetersäure,
die weiter zu Lachgas und Wasser zerfallen:
NH4NO3 Lachgas bildet sich auch
bei starker Stickstoffdüngung. Es ist wesentlich am natürlichen Stickstoffkreislauf beteiligt. Lachgas
gehört zu den Treibhausgasen und
es spielt bei den ozonabbauenden Kreislaufprozessen in der Stratosphäre
eine Rolle. |