
|
Weißes, kristallines Pulver Vorkommen Stoffwechsel, Zitronen, Beeren, Tabak, Pilze, Nadelhölzer |
Molmasse
192,124 g/mol
AGW 2 mg/m³ E (TRGS 900) Dichte (wasserfrei) 1,665 g/cm3 Schmelzpunkt +153 °C Zersetzung bei +175 °C Wasserlöslichkeit Konz. bei 20 °C 605 g/l |
| Piktogramme
GHS 07 Achtung |
Gefahrenklassen
+ Kategorie
Schwere Augenschäd./-reizung 2 |
HP-Sätze
(siehe auch Hinweis)
H 319, 335 P 280.3+5, 305+351+338 Entsorgung mit Wasser verdünnt in Abwasser |
| Etikett drucken | Dt. Bezeichnung
Synonyme (deutsch) |
Engl. Bezeichnung
Synonyme (engl.) |
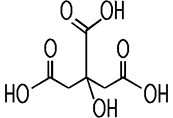
| CAS 77-92-9 | Citronensäure
2-Hydroxy-1,2,3-propan-tricarbonsäure |
Citric acid
2-Hydroxy-1,2,3-propane-tricarboxylic acid |
|
Bemerkungen für Schulen und zum Gebrauch als Entkalker
im Haushalt: Citronensäure verursacht schwere Augenreizungen. Beim
Arbeiten mit Citronensäure muss eine Schutzbrille getragen werden.
Beim Entkalken ist auf eine gute Raumlüftung zu achten.
Eigenschaften Die reine, wasserfreie
Citronensäure bildet farblose rhombische
Kristalle, die leicht sauer schmecken. Sie lösen sich gut in
Wasser
und in Ethylalkohol. In der Natur kommt die Citronensäure in
zahlreichen
Früchten vor. In geringen Mengen eingenommen fördert
Citronensäure das Knochenwachstum. In hohen Konzentrationen wirkt
sie toxisch. Beim Erhitzen zersetzt sie sich ab 175 °C.
Reine Zitronensäure ist ein weißer, kristalliner Stoff Mit dem Natriumhydrogencarbonat aus Backpulver und Wasser entwickelt sich in einer heftigen Reaktion Kohlenstoffdioxid. Citronensäure gehört zur Klasse der organischen Hydroxy-Carbonsäuren
und besitzt drei Carboxy-Gruppen COOH. Mit Alkalimetallen wie Lithium,
Natrium oder Kalium
bildet sie ihre Salze, die Citrate. Salze wie Natriumcitrat kann man auch durch eine Neutralisation einer wässrigen Citronensäure-Lösung mit Natriumhydroxid herstellen.
Alle drei Carboxy-Gruppen können Protonen abspalten, wenn die Citronensäure mit Wasser vermischt wird. Daher wirkt die Citronensäure als Säure. Eine wässrige Citronensäurelösung leitet elektrischen Strom, da beim Lösen der Säure in Wasser Ionen als Ladungsträger gebildet werden. An den Carboxy-Gruppen kann auch eine Veresterung mit Alkoholen zu Citronensäureestern stattfinden. Diese besitzen als Weichmacher für Kunststoffe Bedeutung. |
| Herstellung
Früher erfolgte
die Herstellung fast ausschließlich aus Citrusfrüchten. Dieses
Verfahren kann im Labor nachvollzogen werden: Citronensaft wird mit konzentrierter
Ammoniaklösung versetzt und filtriert. Im
Filtrat findet sich Ammoniumcitrat, welches durch eine Fällungsreaktion
mit Calciumchlorid zu Calciumcitrat umgewandelt werden kann. Nach erneuter
Filtration wird der Rückstand mit 25%-iger Schwefelsäure
versetzt und nochmals filtriert. Im Filtrat findet sich nun eine Citronensäurelösung,
im Rückstand bleibt Gips zurück. Die reine Citronensäure
erhält man durch eine anschließende Kristallisation. Heute gewinnt
man Citronensäure durch eine mikrobiologische Fermentation
aus Zuckerabfällen unter Mithilfe des Schimmelpilzes Aspergillus
niger.
|
| Verwendung
Citronensäure dient als
Zusatzstoff E 330 zum
Ansäuern von Lebensmitteln. Man findet sie in Backpulvern,
Brauselimonaden, Getränken und Backwaren. In kosmetischen Produkten
wird der pH-Wert mit Citronensäure eingestellt. Die Säure
wird zum Reinigen von Metallflächen und zum
Entkalken verwendet. Sie eignet sich auch als Beizmittel zum Färben
von Textilien. In Blutkonserven verhindert sie die Blutgerinnung. Mit
Citronensäure lassen sich Tinteflecken entfärben und auch
Olivenöl verliert durch die Citronensäure einen Teil seiner
Farbe.
|