Ein Ester entsteht, wenn eine Säure mit einem Alkohol oder einem Phenol unter Wasserabspaltung reagiert. Mit Carbonsäuren und Alkoholen enthält man die Carbonsäureester, die in der Natur vor allem in Früchten und in Fetten und Ölen vorkommen. Sie werden als Duft- und Aromastoffe in großer Vielfalt eingesetzt. Ein bekannter Salpetersäureester aus Glycerin und Salpetersäure ist der Sprengstoff Nitroglycerin. Bei der
Schießbaumwolle ist
Cellulose mit Salpetersäure verestert. Phosphorsäureester sind am Aufbau der DNS beteiligt. Einige Vertreter wurden als Insektizide und leider auch als Kampfstoffe im Ersten Weltkrieg eingesetzt. Einfache Schwefelsäureester wie
Schwefelsäuredimethylester (Dimethylsulfat) sind stark toxisch.
Langkettige Schwefelsäureester werden als Fettalkoholsulfate
bezeichnet, sie kommen in Waschmitteln zum Einsatz.
Die Bezeichnung Ester prägte der deutsche Chemiker Gmelin im Jahre 1850 aus dem heute veralteten
Begriff „Essigäther“. In Anlehnung an die anorganischen
Salze erhalten die Ester die Endung -at, Ethylacetat ist ein Beispiel dafür. Eine andere Möglichkeit ist die Nennung
des Namens der ursprünglichen Säure und danach des beteiligten
Alkohols mit der Endung -ester, Essigsäureethylester ist eine andere Bezeichnung für Ethylacetat.
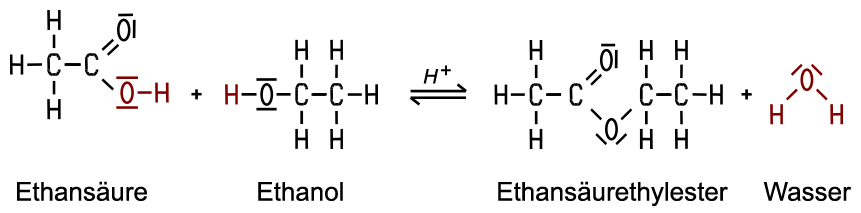
Ester entstehen, wenn eine Säure mit einem primären oder sekundären Alkohol reagiert.
Die Ester-Reaktion ist
eine Gleichgewichtsreaktion mit geringer Reaktionsgeschwindigkeit,
so dass der entsprechende Ester oft erst nach Tagen entsteht. Starke Säuren
wie konzentrierte Schwefelsäure
wirken als Katalysator, Wärme beschleunigt die
Reaktion. Bei der Kondensationsreaktion verbinden sich zwei Moleküle unter Wasserabspaltung.
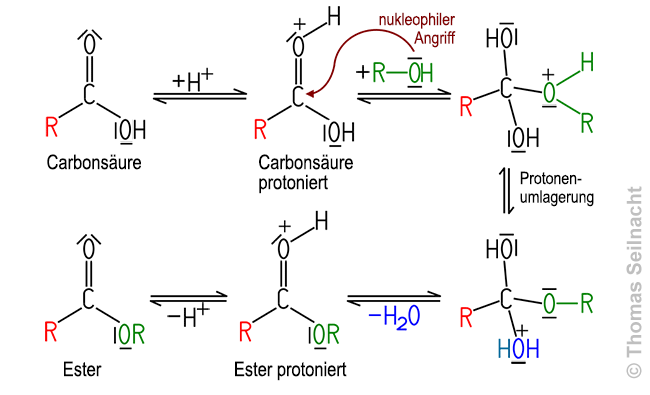
Die Esterreaktion verläuft in mehreren Schritten. Der Mechanismus kann so erklärt werden:
1. Protonierung. Zunächst wird die Carbonylgruppe durch ein Proton (H+) protoniert. Dadurch wird die C=O-Bindung stärker polarisiert und das Kohlenstoff-Atom der Carbonylgruppe wird stärker elektrophil. Es entsteht ein protoniertes Carbonsäure-Molekül.
2. Nucleophiler Angriff des Alkohols. Das Sauerstoff-Atom des Alkohol-Moleküls wirkt als Nukleophil und greift den elektrophilen Carbonylkohlenstoff an. Dabei wird die π-Bindung der C=O-Gruppe aufgelöst und es entsteht ein tetraedrisches Zwischenprodukt.
3. Wasserabspaltung. Durch eine Protonenumlagerung wird eine OH-Gruppe protoniert, ein Wasser-Molekül kann dadurch abgespalten werden. Beim Austritt des Wasser-Moleküls bildet sich erneut eine C=O-Bindung, es entsteht ein protoniertes Ester-Molekül.
4. Deprotonierung. Im letzten Schritt wird das überschüssige Proton wieder abgegeben. Dadurch entsteht der Ester als Produkt, und der Säurekatalysator wird regeneriert.
Die Rückreaktion der Esterbildung ist möglich. Wird der Ester mit Hilfe von Laugen gespalten, spricht man von Verseifung. Bei den Fetten ist der dreiwertige Alkohol Glycerin mit drei Fettsäure-Molekülen verestert, so dass ein Triglycerid entsteht. Erhitzt man ein Triglycerid, das aus drei Molekülen Stearinsäure gebildet wurde, mit Natronlauge, erhält man in einer Verseifung Glycerin und das Salz der ursprünglichen Fettsäure, eine Seife:
1. Protonierung. Zunächst wird die Carbonylgruppe durch ein Proton (H+) protoniert. Dadurch wird die C=O-Bindung stärker polarisiert und das Kohlenstoff-Atom der Carbonylgruppe wird stärker elektrophil. Es entsteht ein protoniertes Carbonsäure-Molekül.
2. Nucleophiler Angriff des Alkohols. Das Sauerstoff-Atom des Alkohol-Moleküls wirkt als Nukleophil und greift den elektrophilen Carbonylkohlenstoff an. Dabei wird die π-Bindung der C=O-Gruppe aufgelöst und es entsteht ein tetraedrisches Zwischenprodukt.
3. Wasserabspaltung. Durch eine Protonenumlagerung wird eine OH-Gruppe protoniert, ein Wasser-Molekül kann dadurch abgespalten werden. Beim Austritt des Wasser-Moleküls bildet sich erneut eine C=O-Bindung, es entsteht ein protoniertes Ester-Molekül.
4. Deprotonierung. Im letzten Schritt wird das überschüssige Proton wieder abgegeben. Dadurch entsteht der Ester als Produkt, und der Säurekatalysator wird regeneriert.
Die Rückreaktion der Esterbildung ist möglich. Wird der Ester mit Hilfe von Laugen gespalten, spricht man von Verseifung. Bei den Fetten ist der dreiwertige Alkohol Glycerin mit drei Fettsäure-Molekülen verestert, so dass ein Triglycerid entsteht. Erhitzt man ein Triglycerid, das aus drei Molekülen Stearinsäure gebildet wurde, mit Natronlauge, erhält man in einer Verseifung Glycerin und das Salz der ursprünglichen Fettsäure, eine Seife:
Triglycerid + 3 NaOH
Ester aus langkettigen Carbonsäuren und langkettigen Alkoholen,
bezeichnet man als Wachse. Die
Ester der kurzkettigen
Säuren und Alkoholen sind farblose Flüssigkeiten und zeichnen
sich durch intensive, fruchtartige Gerüche aus. Sie sind
Bestandteile vieler natürlicher und künstlicher Aromastoffe.
Die Tabelle
gibt einen Ausschnitt aus der Vielfalt der Ester-Aromen wieder:
| Name des Esters | Aroma |
| Ameisensäureethylester | Rum |
| Essigsäurepropylester | Birne |
| Essigsäurepentylester | Birne, Banane |
| Propionsäureethylester | Rum |
| Propionsäurepentylester | Apfel |
| Buttersäuremethylester | Ananas |
Ester sind nur schlecht
wasserlöslich und besitzen eine geringere Dichte als Wasser. Sie reizen
in hoher Konzentration die Atemwege und wirken narkotisch. Neben ihrer
Verwendung als Aromastoffe werden sie hauptsächlich als Lösungsmittel
eingesetzt.
Experimentieranleitung zur Estersynthese
Buch individuell erstellen: Basis-Text Ester


> Inhaltsverzeichnis