 Teflonverschluss |
 Farblose bis gelbe Flüssigkeit Vorkommen Bittermandeln, Kerne von Kernobst, Wein |
Molmasse 106,122 g/mol AGW keine Angaben Dichte 1,0401 g/cm3 Schmelzpunkt −57,12 °C Siedepunkt +178,7 °C Brechungsindex (20°C) 1,5463 Wasserlöslichkeit Konz. bei 20 °C 3 g/l Explosionsgrz. 1,4 Vol.-% (untere in Luft) Flammpunkt +63 °C Zündpunkt +192 °C |
| Piktogramm GHS 07 GHS 08 GHS 09 Gefahr |
Gefahrenklassen
+ Kategorie Akute Toxizität oral/inhalativ 4 Augenreizung 2 Reizwirkung auf die Haut 2 Spez. Zielorgan-Tox. 3 (Atemwege) Reproduktionstoxizität 1B Gewässergefährdend chron. 2 |
HP-Sätze (siehe Hinweis) H 302, 315, 319, 332, 335, 360D, 411 P 273, 280.1–3, 7, 301+312, 302-352, 304+340+312, 305+351+338, 308+313 Entsorgung G 1 |
| Etikett drucken | Dt. Bezeichnung Synonyme (deutsch) |
Engl. Bezeichnung Synonyme (engl.) |
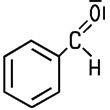
| CAS 100-52-7 | Benzaldehyd Benzencarbaldehyd |
Benzaldehyde Benzencarboxaldehyde |
Bemerkungen
für Schulen: Es wird empfohlen, einen Teflonverschluss zu
verwenden, da die Flüssigkeit intensiv riecht. Manche Hersteller stufen Benzaldehyd als reprotoxisch ein, Verbotsvorschriften beachten! Schutzbrillen, ein
Schutzkittel und geeignete Schutzhandschuhe aus Butylkautschuk
schützen vor dem Kontakt. Nur im Abzug arbeiten!
Eigenschaften
Reiner Benzaldehyd ist eine klare, farblose Flüssigkeit, die sich gelb verfärben kann. Liebig und Wöhler stellten den aromatischen Aldehyd im Jahr 1819 aus Bittermandeln her und gaben ihm den Namen „Bittermandelöl“. Die Geruchschwelle der penetrant nach Marzipan riechenden Flüssigkeit liegt bei etwa 1,8 Milligramm pro Kubikmeter Luft. In starker Verdünnung mit Alkohol, zum Beispiel im Rotwein, ist ein Wildkirscharoma wahrnehmbar. Reiner Benzaldehyd hat einen Brechungsindex von 1,5463 und ist damit stark lichtbrechend. Die Flüssigkeit löst sich gut in organischen Lösungsmitteln wie Ethanol oder Aceton, in Wasser ist sie nicht besonders gut löslich.  In den Bittermandeln
und in den Kernen von Äpfeln, Pfirsichen, Aprikosen oder Pflaumen
kommt Amygdalin vor, das durch enzymatische Reaktionen zu Glucose,
Benzaldehyd und Blausäure reagieren kann. Mit Sauerstoff und sogar bereits an der Luft oxidiert Benzaldehyd zu Benzoesäure.
Verteilt man zum Beispiel wenig Benzaldehyd auf einer Glasplatte,
findet man nach einem Tag Benzoesäurekristalle auf der Platte. Die
autokatalytische Reaktion wird durch Licht, Radikale oder Metall-Ionen
begünstigt. Die Oxidation kann durch Zugabe von Hydrochinon verhindert werden. Die Tollens-Probe und auch die Schiffsche Probe mit Benzaldehyd verlaufen wie bei den aliphatischen Aldehyden positiv, die Fehling-Reagenz wird dagegen nicht reduziert. Benzaldehyd geht zahlreiche Reaktionen ein und ist ein wichtiges Zwischenprodukt der chemischen Industrie, beispielsweise für Farbstoff- oder Duftstoffsynthesen. Durch eine Nitrierung entsteht Nitrobenzaldehyd, das für die Synthese von Indigo von Bedeutung ist. Mit Acetaldehyd oder Aceton erhält man Zimtaldehyd. Diese nach Zimt riechende, ölige Flüssigkeit wird als Duftstoff in Parfüms verwendet. |
| Herstellung Durch eine Chlorierung von Toluol erhält man Dichlormethylbenzol (Benzalchlorid), das mit Wasser beim Erhitzen zu Benzaldehyd und Chlorwasserstoff reagiert. Das Produkt ist mit Benzoesäure verunreinigt. Durch die direkte Oxidation des Toluols mit Luftsauerstoff entsteht ebenfalls Benzaldehyd. Daneben existieren zahlreiche weitere Verfahren zur Synthese des Aldehyds. |
| Verwendung Benzaldehyd ist ein
wichtiges Zwischenpodukt der chemischen Industrie für Synthesen von
Triphenylmethanfarbstoffen, Duftstoffen wie Zimtaldehyd oder Medikamenten. Der Aldehyd
selbst wird auch in Parfüms als Duftstoffkomponente eingesetzt.
Natürliche Gehalte im Wein bilden eine Komponente des Weinaromas.  Bittermandelkerne können neben Blausäure auch Benzaldehyd freisetzen. |