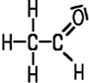
Acetaldehyd
C2H4O
Acetaldehyd
Ethanal
Ethanal
Acetaldehyde
Ethanal
Ethanal
Molmasse
AGW
Dichte
Schmelzpunkt
Siedepunkt
Wasserlöslichkeit
Brechungsindex (20°C)
Explosionsgrenzen
Flammpunkt
Zündpunkt
AGW
Dichte
Schmelzpunkt
Siedepunkt
Wasserlöslichkeit
Brechungsindex (20°C)
Explosionsgrenzen
Flammpunkt
Zündpunkt
44,053 g/mol
entfällt (krebserzeugender Stoff)
0,7834 g/cm3
−123,4 °C
+20,8 °C
vollständig mischbar
1,3316
4 bis 60 Vol.-% (Luft)
−39 °C
+175 °C
entfällt (krebserzeugender Stoff)
0,7834 g/cm3
−123,4 °C
+20,8 °C
vollständig mischbar
1,3316
4 bis 60 Vol.-% (Luft)
−39 °C
+175 °C
Bei 20 °C farblose, sehr leicht verdampfende Flüssigkeit
Teflonverschluss

Gefahrenklassen + Kategorie
Entzündbare Flüssigkeiten 1
Schwere Augenreizung 2
Spez. Zielorgantox. e. Atemwege 3
Keimzellenmutagenität 2
Karzinogenität 1B
Entzündbare Flüssigkeiten 1
Schwere Augenreizung 2
Spez. Zielorgantox. e. Atemwege 3
Keimzellenmutagenität 2
Karzinogenität 1B
Acetaldehyd kann vermutlich genetische Defekte verursachen und ist ein krebserzeugender Stoff der Kategorie 1B. Er ist nach der deutschen RISU an Schulen nicht erlaubt. Die extrem entzündbare Flüssigkeit verdampft bereits bei Raumtemperatur und bildet mit Luft explosionsfähige Gemische.
Wirkung auf den menschlichen Körper
Geringe Acetaldehyd-Spuren können im Blut vorkommen. Acetaldehyd entsteht auch als Nebenprodukt bei der alkoholischen Gärung, man findet ihn in Spuren im Obst oder im Joghurt. Acetaldehyd ist zwar ein Zwischenprodukt im Stoffwechsel, doch die zusätzliche Zufuhr in den menschlichen Körper kann gefährlich sein. Der Stoff reizt akut die Augen, die Atemwege und die Haut, es können auch Wirkungen auf das Zentralnervensystem auftreten. Als chronische Langzeitwirkung treten Bindehautentzündungen am Auge und Hautentzündungen auf. Bei regelmäßigem Alkoholkonsum wird Alkohol in der Leber zu Acetaldehyd umgebaut. Der so gebildete Acetaldehyd erzeugt Kopfschmerzen und schädigt die Leber. In einigen Fällen entwickelt der menschliche Körper Antikörper gegen den Fremdstoff, die dann wiederum den Körper selbst schädigen. Das entspricht dem Prinzip einer Autoimmunkrankheit, die in diesem Fall alkoholbedingt ist. Acetaldehyd ist auch dafür verantwortlich, dass beim übermäßigen Alkoholkonsum die Leber geschädigt wird und eine Leberzirrhose entsteht. Acetaldehyd ist im Zigarettenrauch enthalten und verursacht bei Rauchern eine erhöhte Wahrscheinlichkeit an Krebs im oberen Verdauungstrakt (Mund, Speiseröhre) und er gelangt über die Lunge ins Blut. Auch aus Tierversuchen hat sich ergeben, dass Acetaldeyhd ein krebserzeugender Stoff ist. Insofern erscheint es unverständlich, dass Acetaldehyd – wenn auch in geringen Dosen – in einigen PET-Flaschen der Getränke herstellungsbedingt enthalten ist. Wenn auch die Grenzwerte eingehalten werden, es gibt Personen, die dieses Aroma in den PET-Flaschen schmecken und verabscheuen und darauf mit Unverträglichkeiten reagieren.

Chemisch-physikalische Eigenschaften
Reiner Acetaldehyd ist eine farblose, leicht bewegliche und extrem entzündbare Flüssigkeit mit einem stechend betäubendem Geruch. Sie mischt sich gut mit Wasser und vielen organischen Lösungsmitteln. Der Aldehyd siedet bereits bei +20 °C und bildet dann explosionsfähige Luft-Gemische. Aus diesem Grund muss er kühl gelagert werden. Beim längeren Lagern färbt sich die Flüssigkeit aufgrund ihrer chemischen Instabilität leicht gelblich. Dabei wandelt sich der Acetaldehyd zu der cyclischen, trimeren Verbindung Paraldehyd um.
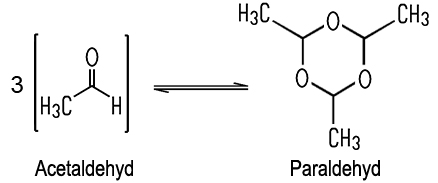
Drei Moleküle Acetaldehyd bilden eine ringförmige Verbindung. Diese Flüssigkeit besitzt zwar einen höheren Siedepunkt (+124 °C), ist aber ebenfalls nicht stabil. So können beim Lagern von Acetaldehyd neue Produkte entstehen. Der Aldehydnachweis mit Schiffs Reagenz verläuft wie bei allen Aldehyden positiv. Bei Anwesenheit eines Aldehyds färbt sich die farblose Lösung violett.
Geringe Acetaldehyd-Spuren können im Blut vorkommen. Acetaldehyd entsteht auch als Nebenprodukt bei der alkoholischen Gärung, man findet ihn in Spuren im Obst oder im Joghurt. Acetaldehyd ist zwar ein Zwischenprodukt im Stoffwechsel, doch die zusätzliche Zufuhr in den menschlichen Körper kann gefährlich sein. Der Stoff reizt akut die Augen, die Atemwege und die Haut, es können auch Wirkungen auf das Zentralnervensystem auftreten. Als chronische Langzeitwirkung treten Bindehautentzündungen am Auge und Hautentzündungen auf. Bei regelmäßigem Alkoholkonsum wird Alkohol in der Leber zu Acetaldehyd umgebaut. Der so gebildete Acetaldehyd erzeugt Kopfschmerzen und schädigt die Leber. In einigen Fällen entwickelt der menschliche Körper Antikörper gegen den Fremdstoff, die dann wiederum den Körper selbst schädigen. Das entspricht dem Prinzip einer Autoimmunkrankheit, die in diesem Fall alkoholbedingt ist. Acetaldehyd ist auch dafür verantwortlich, dass beim übermäßigen Alkoholkonsum die Leber geschädigt wird und eine Leberzirrhose entsteht. Acetaldehyd ist im Zigarettenrauch enthalten und verursacht bei Rauchern eine erhöhte Wahrscheinlichkeit an Krebs im oberen Verdauungstrakt (Mund, Speiseröhre) und er gelangt über die Lunge ins Blut. Auch aus Tierversuchen hat sich ergeben, dass Acetaldeyhd ein krebserzeugender Stoff ist. Insofern erscheint es unverständlich, dass Acetaldehyd – wenn auch in geringen Dosen – in einigen PET-Flaschen der Getränke herstellungsbedingt enthalten ist. Wenn auch die Grenzwerte eingehalten werden, es gibt Personen, die dieses Aroma in den PET-Flaschen schmecken und verabscheuen und darauf mit Unverträglichkeiten reagieren.
Chemisch-physikalische Eigenschaften
Reiner Acetaldehyd ist eine farblose, leicht bewegliche und extrem entzündbare Flüssigkeit mit einem stechend betäubendem Geruch. Sie mischt sich gut mit Wasser und vielen organischen Lösungsmitteln. Der Aldehyd siedet bereits bei +20 °C und bildet dann explosionsfähige Luft-Gemische. Aus diesem Grund muss er kühl gelagert werden. Beim längeren Lagern färbt sich die Flüssigkeit aufgrund ihrer chemischen Instabilität leicht gelblich. Dabei wandelt sich der Acetaldehyd zu der cyclischen, trimeren Verbindung Paraldehyd um.

Drei Moleküle Acetaldehyd bilden eine ringförmige Verbindung. Diese Flüssigkeit besitzt zwar einen höheren Siedepunkt (+124 °C), ist aber ebenfalls nicht stabil. So können beim Lagern von Acetaldehyd neue Produkte entstehen. Der Aldehydnachweis mit Schiffs Reagenz verläuft wie bei allen Aldehyden positiv. Bei Anwesenheit eines Aldehyds färbt sich die farblose Lösung violett.
Im Labor kann Acetaldehyd mit oxidiertem Kupfer hergestellt werden. Taucht man ein oxidiertes Kupferdrahtnetz in ein Reagenzglas mit Ethylalkohol wird das Kupferoxid des Drahtnetzes wieder zu reinem Kupfer reduziert, und dann entsteht unter Wasserabspaltung Ethanal (analoge Reaktionsgleichung siehe Formaldehyd). Eine weitere Darstellungsmöglichkeit im Labor wäre die Oxidation des Ethylalkohols mit Hilfe von Kaliumdichromat und Schwefelsäure:
Die technische Gewinnung aus Ethylalkohol durch eine Dehydrierung ist heute nicht mehr so bedeutend. Hierbei reagiert Ethylalkohol bei 550 °C an der Luft am Silberkontakt und gibt ein Wassermolekül ab:
In der chemischen Industrie erfolgt die Synthese heute überwiegend nach dem Wacker-Hoechst-Verfahren. Ethen reagiert mit Luft oder Sauerstoff in einer wässrigen Palladiumchlorid-Kupferchlorid-Lösung zu Ethanal:
CH3-CH2OH + 2 CrO3  3 CH3-CHO + Cr2O3 + 3 H2O
3 CH3-CHO + Cr2O3 + 3 H2O
Die technische Gewinnung aus Ethylalkohol durch eine Dehydrierung ist heute nicht mehr so bedeutend. Hierbei reagiert Ethylalkohol bei 550 °C an der Luft am Silberkontakt und gibt ein Wassermolekül ab:
CH3-CH2OH + ½ O2  CH3-CHO + H2O
CH3-CHO + H2O
In der chemischen Industrie erfolgt die Synthese heute überwiegend nach dem Wacker-Hoechst-Verfahren. Ethen reagiert mit Luft oder Sauerstoff in einer wässrigen Palladiumchlorid-Kupferchlorid-Lösung zu Ethanal:
CH2=CH2 + ½ O2  CH3-CHO ΔH = −218 kJ/Mol
CH3-CHO ΔH = −218 kJ/Mol
Acetaldehyd wird hauptsächlich zur Gewinnung von Essigsäure eingesetzt. Die chemische Industrie synthetisiert daraus aber auch eine ganze Reihe weiterer Verbindungen, beispielsweise Essigsäureanhydrid, Essigsäureethylester, Aceton, Ethylalkohol, Acrolein, Crotonaldehyd, Chloral, Glyoxal, Zimtaldehyd oder Pentaerythrit. Dieser vierwertige Alkohol dient zur Herstellung des Sprengstoffs Nitropenta.
© Thomas Seilnacht / Benutzerhandbuch / Lizenzbestimmungen / Impressum / Datenschutz / Literaturquellen