|
Nur für Lehrkräfte an Hochschulen geeignet
Inhalt
Didaktische Bemerkungen Demonstration 1 Liesegangsche Ringe Demonstration 2 Oszillierende Reaktionen Weiterführende Links Literatur
Friedrich Ferdinand Runge
(1794–1867) führte Versuche durch, bei denen nach dem Auftragen von
Farbstoffen auf Fließpapier räumliche Muster entstanden. Sie
gelten als Vorläufer für die Papier-Chromatografie.
Im Jahre 1896 beschrieb Raphael Eduard Liesegang (1869–1947) das periodische
und rhythmische Auftreten von Strukturen bei chemischen Reaktionen. Beim
Auftropfen von Silbernitrat-Lösung
auf ein mit Kaliumdichromat vermischtes Gelatine-Gel entstanden in rhythmischer
Periode Ringe von Silberchromat-Ausfällungen. Diese Ringe erhielten
später nach dem Namen des Entdeckers die Bezeichnung „Liesegangsche
Ringe“. Auch der Chemiker Wilhelm Ostwald forschte an den periodisch auftretenden
Reaktionen und versuchte, die chemischen Vorgänge zu erklären
(vgl. weiterführende Links).
Heute lassen sich zahlreiche
Phänomene und Vorgänge in der Natur durch das Auftreten von periodischen
Strukuren bei chemischen Vorgängen erklären. So entstehen auch
Ringe, die machmal bei Anschliffen des Edelsteins Achat sichtbar werden.
Liesegang erforschte die Strukturen im Achat in langjähriger Arbeit.
a) Periodische Strukturen auf einem Gel In einem 250ml-Becherglas werden 0,4 g Kaliumdichromat, 12 g Gelatinepulver in 100 ml Wasser gegeben und auf dem Dreifuß oder einem heizbaren Magnetrührer unter ständigem Rühren solange erhitzt, bis die Gelatine mit dem Wasser ein klares Gel bildet. Die heiße, gelbe Flüssigkeit wird in mehrere Petrischalen und Reagenzgläser verteilt. Das Gel in den Petrischalen bildet eine dünne Schicht, während die Reagenzgläser zur Hälfte gefüllt werden. Direkt nach dem Erstarren des Gels wird in die Mitte der Petrischale ein dicker Tropfen 1molare Silbernitrat-Lösung gegeben (etwa 17 g Silbernitrat auf 100 ml Lösung). Nach dem Abdecken der Schale stellt man diese an einen ruhigen Ort und wartet mehrere Stunden ab. Die erstarrte Gelschicht in den Reagenzgläsern wird 1 bis 2 mm hoch mit der Silbernitrat-Lösung überschichtet und an einen ruhigen Ort gestellt. Beobachtungen: Schon nach kurzer Zeit entsteht in der Petrischale unter der Silbernitrat-Lösung ein dunkelbrauner Fleck (Silberchromat), der sich sehr langsam ausbreitet. Nach ein paar Stunden sind konzentrische Kreise um den Tropfen herum erkennbar, die eine periodische Struktur aufweisen (Bild links). Im Reagenzglas entsteht eine periodische Fällung von Silberchromat (Bild rechts).
b) Periodische Strukturen
bei Gasen
Zunächst wird die
Apparatur ohne Füllungen aufgebaut. Zwei Gaswaschflaschen werden gegenläufig
mit einer ungefähr 40 cm langen Glasröhre (d = 8 mm) verbunden und aufgestellt.
Dann füllt man die eine Gaswaschflasche 5 cm hoch mit rauchender Salzsäure
und die andere 5 cm hoch mit konzentrierter Ammoniaklösung. Die Apparatur
stellt man in einen Abzug und betrachtet am nächsten Morgen den entstandenen
Effekt.
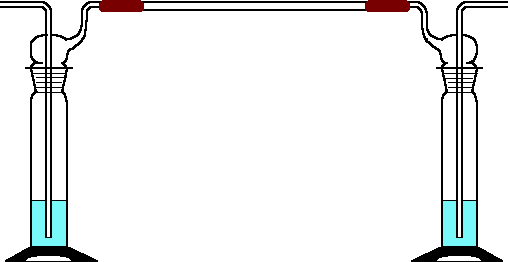
Beobachtungen:
Nach wenigen Minuten bildet sich an einer
Stelle des Glasrohres ein weißer Nebelring. Am nächsten Morgen
sind im Glasrohr auf einer Seite periodische Ringe entstanden, die regelmäßige
Strukturen aufweisen:
Theorie:
An der Stelle, wo die beiden Gase zusammentreffen,
entsteht als Reaktionsprodukt weißes Ammoniumchlorid:
NH3 +
HCl
Dabei wird der gesamte Chlorwasserstoff in der unmittelbaren Umgebung durch einen Überschuss an Ammoniak verbraucht. Durch Diffusion von weiterem Chlorwasserstoff und einer erneuten Ausfällung von Ammoniumchlorid entsteht eine Zone, die kaum Chlorwasserstoff mehr enthält. Das Ammoniak diffundiert schneller als der Chlorwasserstoff, so dass eine Sogwirkung entsteht, das Häutchen bewegt sich in Richtung des Chlorwasserstoffs. Nach einer Weile wird wieder eine Zone mit mehr Chlorwasserstoff erreicht, so dass eine erneute Ausfällung stattfindet und ein neuer Ring entsteht.
Variante 1: Ausbildung periodischer und räumlicher Strukturen in einer Petrischale
Von den beiden Lösungen
werden je 10 ml in einem gut verschließbaren Reagenzglas 30×200 mm
(oder in einem Standzylinder, Erlenmeyerkolben, etc.) vermischt und so
lange geschüttelt, bis das entstehende braune Brom verschwunden und
die Lösung wieder klar ist. Nach der Zugabe von 30 Tropfen 0,025molarer
Ferroinlösung wird das gut geschüttelte Gemisch in eine Petrischale
gefüllt, so dass der Boden flach bedeckt ist. Diese stellt man auf
einen Overheadprojektor und wartet ab.
Beobachtungen: In der zunächst roten Lösung bilden sich hellblaue Flecken, aus denen konzentrische Kreise herauswachsen. Das Entstehen der räumlichen Strukturen in dem flachen Gefäß verläuft sehr langsam. Aufschlussreich ist auch die Durchführung mehrerer Versuchsreihen, da dabei immer wieder andere Muster und Strukturen entstehen.
Variante
2: Oszillierende Farbwechsel in einem Standbehälter
Die beiden Lösungen
sollten etwa eine Stunde stehen bleiben, bevor man sie weiter verwendet.
Dann werden beide in ein großes Reagenzglas 30×200 mm gegeben und
bei aufgesetztem Stopfen gut durchgeschüttelt, bis alles Brom wieder
verschwunden ist. Nach der Zugabe von 20 Tropfen 0,025molarer Ferroinlösung
befestigt man das Reagenzglas an einem Stativ und wartet ab. Läuft
die Oszillation nach ein bis zwei Minuten nicht selbständig an, kann
sie eventuell durch die Zugabe von einigen wenigen Tropfen konzentrierter Schwefelsäure
gestartet werden. Findet nur ein einziger Farbumschlag statt, stimmt wahrscheinlich
die Konzentration der Schwefelsäure nicht. Verwendet man größere
Stoffmengen und Gefäße, variiert die zugegebene Menge an Ferroin.
Beobachtungen: Die zunächst rote Lösung färbt sich für kurze Zeit blau und wird dann wieder rot. Der Wechsel von Blau nach Rot läuft danach selbständig ab, wobei die Rotphase wesentlich länger andauert. Die Blauphase läuft meist rhythmisch durch die Lösung. Durch weiteres Experimentieren kann man die bereits oszillierende Lösung beeinflussen, zum Beispiel durch geringe Zugaben von konzentrierter Schwefelsäure oder Malonsäure. Auch eine Erwärmung beeinflusst die Oszillation. Beim Ansatz im Film 2 erwärmte sich die Flüssigkeit durch eine geringe Zugabe von konzentrierter Schwefelsäure und durch die starke Filmlampe, wodurch die Oszillation sehr schnell ablief und eine starke Gasentwicklung feststellbar war. Langsame und durchlaufende Wellen erhält man nur mit viel Glück und Fingerspitzengefühl.
Theorie
Erst die moderne Chemie,
die die Stoffe als Welt der Systeme begreift, kann eine ausreichende Erklärung
zur Entstehung der periodischen Muster liefern. Ein allgemeines, typisches
Merkmal bei chemischen Reaktionen ist die Zunahme der Entropie:
Öffnet man eine Parfümflasche, verteilen sich die Duftmoleküle
im Raum von alleine. Eine spontane Rückkehr sämtlicher Duftmoleküle
in die Flasche kommt praktisch jedoch nicht vor. Eine ungebremste Zunahme
der Entropie im Weltall würde jedoch relativ schnell zu einem totalen
Chaos führen. Daher müssen Steuermechanismen existieren, die
aus dem Chaos wieder geordnete Systeme erschaffen können.
Seit die beiden russischen Chemiker Boris Pavlovich Belousov (1893–1970) und Anatoli Markovitsch Zhabotinsky (1938–2008) oszillierende Reaktionen untersucht und gedeutet haben, weiß man, dass innerhalb von chemischen Reaktionen Rückkopplungseffekte auftreten und damit auch die Fähigkeit zur Selbstorganisation möglich ist. Das bei chemischen Reaktionen oft auftretende Phänomen der Autokatalyse stellt ein System mit positiver Rückkopplung dar: Ein Katalysator entsteht erst während der Reaktion und beschleunigt dadurch die Reaktion immer mehr. Bei Oszillationen entsteht die Rückkopplung aus komplizierten und vernetzten Kreisreaktionen der beteiligten Stoffe, wobei bestimmte Stoffe als Regelelemente auftreten. Wie kompliziert der Mechanismus der Belousov-Zhabotinsky-Reaktion ist, verdeutlicht die Tatsache, dass 21 teilweise nur kurz auftretende Reaktionspartner an 18 Teilreaktionen teilnehmen. Die folgende Beschreibung beschränkt sich daher auf die wesentlichen Reaktionen: 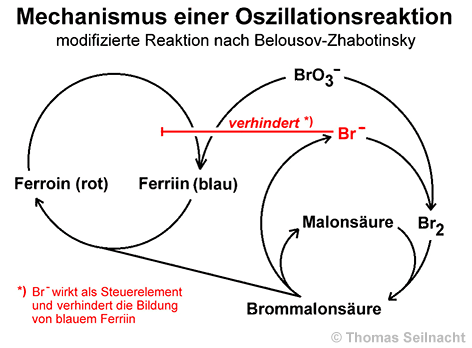
In der Lösung reagieren
das Bromat-Ion (BrO3−) und das Bromid-Iom (Br−)
zu elementarem Brom (Br2). Dieses bildet mit der Malonsäure
Brommalonsäure. Normalerweise würde das Bromat-Ion auch mit dem
Indikator Ferroin (rot) zu Ferriin (blau) reagieren, was aber durch das
Bromid-Ion verhindert wird. Das Bromid-Ion
wirkt als Regelelement und verursacht eine negative
Rückkopplung innerhalb des Gesamtsystems. Erst wenn alle
Bromid-Ionen verbraucht sind, kann die verhinderte Reaktion ablaufen und
(blaues) Ferriin entstehen. Die Brommalonsäure reduziert dann wiederum
das Ferriin zu (rotem) Ferroin, wobei auch wieder Bromid-Ionen gebildet
werden. Der Kreisprozess beginnt von vorne, bis alle Bromat-Ionen verbraucht
sind. So wechselt die Lösung durch das im Regelkreis gesteuerte Paar
Ferroin/Ferriin ständig die Farbe:
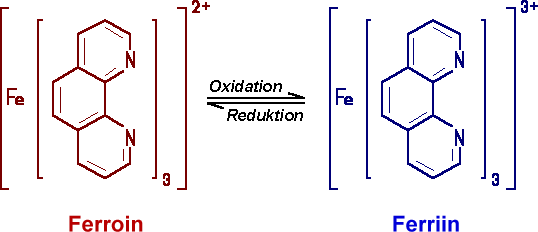 durch Oxidation entsteht Ferriin, das Eisen der Oxidationszahl +III enthält.
Gibt man die oszillierende
Lösung in einen Behälter, findet der oben beschriebene Prozess
nicht gleichzeitig an allen Stellen in der Flüssigkeit statt. Es kann
sein, dass an einer Stelle noch viele Bromid-Ionen vorliegen und an einer
anderen bereits alle verbraucht sind. Auf diese Art und Weise entstehen
innerhalb der Lösung Wellen. Können sich die Wellen nur langsam
ausbreiten (Versuchsvariante 1), dann erhält man räumliche Muster.
Weiterführende
Links
|