Nur für Lehrkräfte geeignet
Inhalt
Didaktische Bemerkungen Demonstration 1 Der Würfelzuckertrick Demonstration 2 Aphlogistische Lampe Demonstration 3 Katalysator-Feuerzeug Demonstration 4 Oszillierendes Herz Demonstration 5 Der aufgeschnittene Apfel Demonstration 6 Elefantenzahnpasta Literatur Nachdem die Schülerinnen und Schüler
verschiedene chemische Reaktionen kennengelernt haben (Sulfid-Reaktionen)
und der Begriff der Aktivierungsenergie bekannt
ist, soll gezeigt werden, dass es Stoffe gibt, die das Ablaufen chemischer
Reaktionen erheblich erleichtern. Katalysatoren und katalytische Vorgänge spielen in der Natur und in der Technik
eine große Rolle. Ohne sie wäre das Leben auf der Erde vermutlich
gar nicht möglich. Zu dem Thema liegt auch ein Arbeitsblatt
für eine Schülerübung vor. Die von den
Schülern
beobachteten Vorgänge werden von Ihnen in einem
„Erlebnisbericht“ zusammengefasst. Dabei äußern sie auch
Vermutungen über
die Eigenarten eines Katalysators. Die Texte und Gedichte
werden zu Beginn
jeder Demonstration gelesen.
Ein Mädchen liebt einen Jungen. Er weiß es noch nicht. Er kennt das Mädchen, ihr hübsches Gesicht. Da findet er eine Rose... An
ein Stück Würfelzucker wird eine Streichholzflamme gehalten.
Der Würfelzucker schmilzt zwar in der Flamme, aber entzünden
lässt er sich nicht. Nun raucht man eine Zigarette oder verbrennt
etwas Tabak mit Hilfe der Tiegelzange in der Brennerflamme und wartet bis
die Asche vollständig verglüht ist. Mit diese Asche benetzt man
mit einem Finger den Würfelzucker. Nun gelingt der Trick: Der Würfelzucker
verbrennt mit einer kleinen, rauschenden Flamme.
Demonstration
2 Aphlogistische Lampe
Du bist gekommen du wieder und immer wieder wieder du (aus „Immer wieder“ von Erich Fried)
Um den Docht eines Spiritusbrenners
wird eine Drahtspirale aus Platin gewunden. Hierzu nimmt man ein 10 Zentimeter langes
Stück Platin-Draht und formt es mit Hilfe eines Glasstabs zu einer
federförmigen Spirale. Diese wird auf den Docht des Brenners gesetzt.
Nach dem Entzünden des Brenners glüht der Platin-Draht hell auf.
Bläst man die Flamme aus, beginnt der Draht nach kurzer Zeit wieder
zu glühen, so dass die Flamme wieder angeht. Dies lässt sich
beliebig oft wiederholen. Bei langem Blasen erkaltet der Draht, dann tritt
der Effekt nicht mehr auf. Auch das Wegnehmen des Sauerstoffs durch Aufsetzen
eines Deckels bewirkt das Abklingen des glühenden Drahtes. (Erklärung
siehe >Katalyse).
Variationen:
Die Demonstration gelingt
auch mit Silber- oder Kupfer-Spiralen. Hierbei wird der Draht mit Schmirgelpapier
aufgeraut und kurz mit 10%iger Salzsäure behandelt, dann erst zu
einer Spirale aufgewickelt. Allerdings reicht das Glühen des Kupfer-
oder Silber-Drahtes meistens nicht aus, um den Brenner wieder zu entzünden.
Der Effekt des Nachglühens von Metallen in brennbaren Gasen kann auch
an Feuerzeugen, die mit einer Glühwendel ausgestattet sind, beobachtet
werden. Man zündet das Feuerzeug, hält die Gaszufuhr gedrückt
und bläst dann die Flamme aus, so dass weiter Gas an der Glühwendel
vorbeiströmt:
Demonstration
3 Katalysator-Feuerzeug
GBU Deutschland für das Arbeiten mit Wasserstoff docx pdf SB Schweiz für das Arbeiten mit Wasserstoff docx pdf Eine mit fein verteiltem
Platin beschichtet Tonerde-Kugel (käuflich) oder selbst hergestellter
Platin-Schwamm wird mit einer Pinzette über einen aus einer Düse
austretenden Strom Wasserstoff-Gas
(aus der Flasche) gehalten. Achtung: In der Düse sollte sich eine
Rückschlagsicherung aus Eisenwolle befinden! Testen Sie die mögliche
Flammenhöhe der Wasserstoff-Flamme vorher! Außerdem sollte die
Raumlüftung aufgrund des entweichenden Wasserstoffs angeschaltet sein!
Nach einer Weile glüht die Kugel auf. Mit etwas Fingerspitzengefühl lässt sich dadurch der Wasserstoff entzünden. Aufgrund dieses Effekts entwickelte J.W. Döbereiner im Jahre 1823 das berühmte „Döbereinersche Feuerzeug“.
Variationen:
Mit Hilfe der glühenden
Platin-Kugel können auch Knallgas-Gemische
entzündet werden. Man
füllt einen 30ml-Plastik-Becher von unten mit einem
Wasserstoff-
Sauerstoff-Gemisch und stellt ihn auf die Glasplatte. Das
Knallgas-Gemisch wird in großen 60ml-Spritzen
(Wasserstoff ÷ Sauerstoff = 2 ÷ 1) oder in einem sauberen
Kolbenprober hergestellt. Dieser ist mit einem sehr kleinen Schlauch
versehen. Dann drückt
man den ganzen Inhalt von unten in den Becher, in dem man
den
Becher nur ganz wenig schräg stellt und den Schlauch
seitlich einführt. Überschüssiges Knallgas entweicht
dabei auf der
Seite, der Überschuss bewirkt eine vollständige
Füllung.
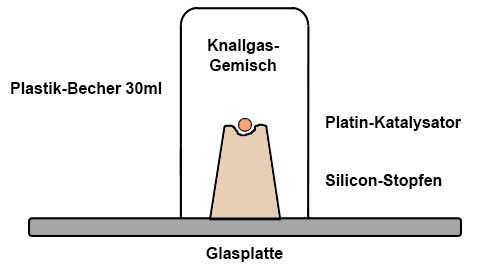
Ein
kleiner Silicon-Stopfen
wird mit einem scharfen Messer an einem Ende etwas
ausgehöhlt (d = 5 mm, Tiefe 2 mm), so dass eine platinbeschichtete
Aluminiumoxid-Kugel
gut in die Mulde passt und nicht mehr herausrollt. Der
präparierte
Stopfen wird auf eine weitere Glasplatte gestellt. Nun
nähert man sich mit
dem Becher auf der Glasplatte vorsichtig und stellt ihn auf
den Stopfen. Dabei darf der Becher nur wenig bewegt und keinesfalls
gekippt werden. Man entfernt sich rasch und
wartet ab.
Film Beobachtungen:
Nach einer Weile beginnt
die auf dem Stopfen liegende Kugel zu glühen. Das Knallgas-Gemisch
explodiert mit einem lauten Knall und der Becher fliegt mit hoher Geschwindigkeit
an die Decke. Danach fühlt sie sich warm an, auf der Glasplatte ist
kurzzeitig ein Beschlag zu sehen.
Achtung: Dieser Versuch darf nur mit einer Schutzbrille durchgeführt werden! Die Zuschauer sind vor dem lauten Knall zu warnen, sie müssen den Mund offen halten! Es dürfen nur Kunststoff-Becher (kein Glas!) mit einem Volumeninhalt mit maximal 30 ml verwendet werden! Kopf und Ohren fernhalten! Eventuell Gehörschutz tragen! Hinweise zum theoretischen Hintergrund für diesen Versuch finden sich im Lexikon unter dem Begriff >Katalyse und beim >Wasserstoff. Demonstration
4 Oszillierendes Herz
Der liebsten Herz ist aufgewacht Als wie die Ros' am Strauche; Die Liebe hat es angefacht Mit einem frischen Hauche. (Friedrich Rückert
aus: Liebesleben)
Dieser Versuch stellt eine rhythmische Variation der aphlogistischen Lampe dar. Die Geräte und Materialien sind bei der Firma Hedinger erhältlich. Der Versuch darf nur auf einer feuersicheren Unterlage und mit Schutzbrille durchgeführt werden. Zu Beginn fragt man die Schüler, woher sie rhythmische Reaktionen in der Natur oder im Alltag kennen. Sie nennen vielleicht die Atmung, den Herzschlag oder Tag und Nacht. Die Herstellung von solchen Analogien ist nicht von ungefähr. Chemische Oszillationen stellen eine Grundlage für die Entstehung des Lebens dar. 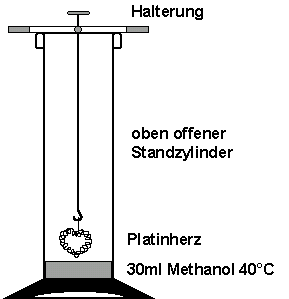
Schutzbrille und Schutzhandschuhe sind zu tragen! Der Raum ist abzudunkeln.
In ein großes Reagenzglas (30×200 mm) werden 30 ml Methanol gegeben und mit einem Feuerzeug vorsichtig erwärmt, so dass die Temperatur
etwa 40 bis 50 °C beträgt. Das erhitzte Methanol gießt man in
einen Standzylinder. Danach hängt man einen zu einem Herz geformten
Platin-Draht an einem Eisen- oder Stahl-Draht so in den Zylinder,
dass das Herz nur weniger Millimeter über dem Methanol hängt.
Man nimmt das Herz wieder heraus und erhitzt es mit der Feuerzeug-Flamme.
Nun hängt man es zügig in den Zylinder. Kopf fernhalten! Während der Reaktion darf man auf keinen Fall Methanol nachgießen!
Beobachtungen:
Nach kurzer Zeit tritt eine lautstarke Verpuffung
auf. Dann beginnt das Herz zu glühen und nach einer Weile entzündet
sich das Methanol in einem kleinen, blauen Flämmchen erneut, das aber
sofort wieder erlischt. Danach treten das Glühen des Herzes und das
Entzünden des Methanols in abwechselnden Phasen auf.
Theorie: Für Schüler sind theoretischen Erklärungen zum Zeitpunkt der Versuchsdurchführung im Unterricht nur bedingt nachvollziehbar. Sie würden auch das Staunen der Schüler zerstören. Das Phänomen spricht für sich. Wollen Sie, lieber Leser, den poetischen Moment bei sich selbst vorerst noch wirken lassen, dann lesen Sie bitte die hier folgenden Erklärungsversuche später! Im Standzylinder konkurrieren mehrere Systeme, die sich gegenseitig beeinflussen. Das Platin-Herz vermag Methanol-Dämpfe in einer endothermen Reaktion zu atomarem Wasserstoff (2H) und Formaldehyd (HCHO) dehydrieren: H3COH
Der atomare Wasserstoff
wird durch das Platin sofort adsorbiert. Von oben gelangt Sauerstoff in
den Zylinder und oxidiert den vorhandenen, atomaren Wasserstoff zu Wasser:
4 H + O2
Diese stark exotherme Reaktion liefert die Energie zum Glühen des Platinherzes bis über 1000 °C. Das glühende Herz liefert auch Wärme zum weiteren Verdampfen von Methanol. Dadurch bildet sich ein explosives Methanol-Luft-Gemisch im Zylinder, das noch mit Formaldehyd angereichert ist. Das Gemisch wird durch das glühende Platin entzündet, so dass es zu einer kleinen Verpuffung kommt: 2 H3COH
+ 3 O2
HCHO + O2 Die Zündtemperatur des Gemisches liegt bei etwa 455 °C. In einer Oxidation entstehen bei dieser Verbrennung die Reaktionsprodukte Wasserdampf (H2O) und Kohlenstoffdioxid (CO2). Zu Beginn der Demonstration beschlägt die Zylinderwand dabei noch mit Wasserdampf. Die Wand erwärmt sich zunehmend, und der Beschlag bleibt aus. Die bei der Verpuffung entstehenden Gase bringen die Flamme schnell wieder zum Erlöschen. Die Gase entweichen durch das Verdampfen des Methanols, und der rhythmische Prozess beginnt von vorne. Variationen
Formen Sie eine Silberdraht-Spirale und probieren Sie den Versuch selbst aus! Welche Nachteile
besitzen Silber- und Kupfer-Spiralen?
Demonstration
5 Der aufgeschnittene Apfel
Herbsthauch Herz, nun so alt und noch immer nicht klug, Hoffst du von Tagen zu Tagen, Was dir der blühende Frühling nicht trug, Werde der Herbst dir noch tragen! Lässt doch der spielende Wind nicht vom Strauch, Immer zu schmeicheln, zu kosen, Rosen entfaltet am Morgen sein Hauch, Abends verstreut er die Rosen. Lässt doch der spielende Wind nicht vom Strauch, Bis er ihn völlig gelichtet. Alles, o Herz, ist ein Wind und ein Hauch, Was wir geliebt und gedichtet. (Friedrich Rückert) Nach dem Vorlesen dieses
Gedichts zur Vergänglichkeit wird ein Apfel oder eine Birne in zwei
Teile zerschnitten. Die eine Hälfte legt man in Wasser, dem noch
ein Teelöffel Vitamin C als Konservierungsstoff zugegeben wurde. Die
andere liegt offen auf dem Tisch. Nach ein paar Minuten hat sich die Hälfte
an der Luft deutlich braun gefärbt. Danach wird das Obst gegessen.
Hinweis: Der Versuch gelingt am besten mit unbehandelten Äpfeln vom
eigenen Baum, bzw. von einem Baum aus dem Schulgarten oder aus dem Bioladen.
Beobachtung:
Nach relativ kurzer Zeit färbt sich aufgeschnittenes
Obst, sofern es nicht behandelt wurde, vor allem um das Kerngehäuse
herum an der Luft braun. Hier wirken Stoffe im Apfel als Biokatalysatoren,
die in Verbindung mit dem Luftsauerstoff wirksam werden. Bei den im Wasser
mit Konservierungsstoff eingelegten Schnitzen findet der Prozess langsamer
statt.
Variationen
Demonstration 6 Elefantenzahnpasta GBU Deutschland docx pdf SB Schweiz docx pdf Ohne Kommentar
Sicherheit: Das entstehende Produkt ist im Chemieunterricht als „Elefantenzahnpasta“ bekannt. Bei der Reaktion können ätzende Spritzer des Wasserstoffperoxids herumfliegen! Die Demonstration darf nur im Abzug in einer großen Wanne durchgeführt werden. Lehrkraft und Zuschauer müssen Schutzbrille, Schutzkittel und Schutzhandschuhe tragen! Vorbereitung: Eine große Plastikwanne wird in den Abzug gestellt. Dann löst man 5 g Kaliumiodid in 5 g destilliertem Wasser in einem 50ml-Becherglas auf. Der Inhalt des Becherglases wird in einen 50ml-Standzylinder gegeben. Dieser wird mit Geschirrspülmittel bis zu 10ml-Markierung aufgefüllt. Vor der eigentlichen Demonstrationen stellt man den präparierten Standzylinder in die Plastikwanne. Durchführung: 30 ml gekühlte Wasserstoffperoxid-Lösung 30 % werden in ein ganz sauberes 50ml-Becherglas gegeben. Der Inhalt wird im laufenden Abzug zügig in den in der Wanne stehenden Standzylinder geschüttet.  Beobachtung: Die Mischung färbt sich sofort bräunlich und steigt im Standzylinder hoch. Es entsteht ein gelber Schaum, der unter starker Volumenvergrößerung in der Wanne eine riesige Figur bildet. Nach einer Weile fällt der Schaum wieder zusammen. Theorie: Die Iodid-Ionen I− im Kaliumiodid wirken als Katalysator. Das gesamte Wasserstoffperoxid wird in einer schnellen Reaktion in Wasser und Sauerstoff aufgespalten. Dabei entstehen als Zwischenprodukt Hypoiodit-Ionen IO−, die Sauerstoff freisetzen können: I− + H2O2 IO− + H2O2 Die Reaktion verläuft unter Wärmeentwicklung stark exotherm, so dass die entstehenden, gasförmigen Reaktionsprodukte durch das Geschirrspülmittel zu einem gelben Schaum vermischt werden, dessen Volumen sich enorm vergrößert. Die gelbe Farbe im Schaum weist auf die Bildung von Iod hin: H2O2 + 2 H3O+ + 2 I− Entsorgung: Der gelbe Schaum darf nicht im Abfluss entsorgt werden. Er wird zunächst in der Wanne stehen gelassen bis er sich zurückbildet und dann mit Wasser vermischt. Das Iod aus dem Schaum wird mit einer wässrigen Natriumthiosulfat-Lösung zum farblosen Iodid reduziert. Dieses kann man dann im Behälter für Schwermetallsalze entsorgen.
|