
|
Weißes, kristallines Pulver Vorkommen Höhere Pflanzen und Tiere |
Molmasse
176,124 g/mol
AGW keine Angaben Dichte 1,65 g/cm3 Zersetzung +191°C Wasserlöslichkeit Konz. bei 20 °C 333 g/l Zündtemperatur +380 °C |
| - | - | Entsorgung Hausmüll/Abwasser |
| Etikett drucken | Deutsche Bezeichnung
Synonyme (deutsch) |
Englische Bezeichnung
Synonyme (engl.) |
| CAS 50-81-7 | Vitamin C
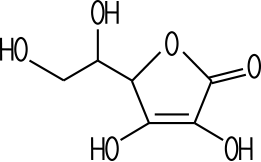
L-(+)-Ascorbinsäure (5R)-5-[(1S)-1,2-Dihydroxyethyl]-3,4-dihydroxy-5-hydrofuran-2-on |
Vitamin C
L-(+)-Ascorbic acid (5R)-5-[(1S)-1,2-Dihydroxyethyl]-3,4-dihydroxy-5-hydrofuran-2-one |
| Eigenschaften
In der Apotheke kann
man reines Vitamin C als Nahrungsergänzungsmittel kaufen. Der
Chemiker kennt den Stoff unter dem Namen Ascorbinsäure. Es ist ein
weißes, kristallines Pulver, das leicht sauer schmeckt.
Ascorbinsäure
ist in Wasser sehr gut löslich, in Alkohol dagegen nicht mehr ganz
so gut. In Diethylether, Benzin oder Fett ist sie unlöslich. Im reinen Zustand ist sie relativ gut gegen Luft, Wärme
und Licht beständig. Sie wird aber in wässriger Lösung oder in feuchtem Zustand durch Wärmeeinwirkung, in Gegenwart von Basen oder durch Spuren von Schwermetall-Ionen zersetzt. Die OH-Gruppen an der
C-C-Doppelbindung im Ring können Protonen abspalten. Dies erklärt die Wirkung als Säure. Ascorbinsäure ist auch ein gutes Reduktionsmittel, da an der gleichen Stelle Sauerstoff-Atome
aufgenommen werden können.
|
| Vorkommen
Besonders hohe Vitamin-C-Gehalte finden sich in zahlreichen Früchten und Gemüsen,
beispielsweise in Citrusfrüchten oder in der Paprika. Die meisten
Kohl-Arten weisen ebenfalls sehr hohe Gehalte auf, während Fleisch-,
Fisch- und Milchprodukte kaum Vitamin C enthalten. Der Mensch kann das Vitamin
nicht selbst bilden, es ist ein essenzieller Stoff. Daher ist der
Mensch auf die Aufnahme aus Nahrungsmitteln angewiesen. Der Tagesbedarf
eines Erwachsenen liegt bei etwa 75 Milligramm. Ein Mangel führt zu
Skorbut.
Die Hagebutten der Heckenrose enthalten viel Vitamin C.
Beim Zubereiten und
beim
Konservieren von Lebensmitteln geht ein Teil des Vitamins verloren wie
die folgende Tabelle zeigt. Der Vitamin-C-Verlust kann aber je nach
Erzeugnis variieren, es sind nur Durchschnittswerte angegeben. Die
schonenste Zubereitung ist das Dünsten. Dabei wird das Gemüse
mit nur ganz wenig Wasser gegart.
Quelle: Zentrum der Gesundheit: Nährstoffverluste beim Kochen, abgerufen auf [1]
Vitamin C ist ein
Vitamin, das bei Licht und Sauerstoff zersetzt wird. Kartoffeln
verlieren beim Lagern pro Monat bis zu 15% ihres Vitamin-C-Gehalts. Beim
Lagern von Spinat kann der Verlust schon nach einem Tag über 50%
liegen. Beim Kochen von Kartoffeln mit Schale im Wasser geht rund ein
Viertel des Vitamins verloren. Kocht man die Kartoffeln ohne Schale, ist
der Verlust doppelt so hoch. Beim Dämpfen, beim Dünsten und
auch beim Frittieren ist der Verlust geringer als beim Kochen im Wasser,
da das wasserlösliche Vitamin nicht ausgewaschen wird. Pommes
enthalten sogar etwas mehr Vitamin C als gekochte Kartoffeln! Vitamin C
ist im sauren Milieu stabil. In einer frischen Orange bleibt es
erhalten, solange diese nicht geschält wird. Sobald eine
Zubereitung erfolgt, beginnt sich das Vitamin C zu zersetzen. Säfte
und zubereitete Speisen sollten sofort konsumiert werden. Beim
Aufwärmen von bereits vorgekochten Speisen gehen erneut 50% des
Vitamins verloren. Am meisten Vitamin C erhält man, wenn man
Gemüse oder Obst möglichst bald nach der Ernte in roher Form
zu sich nimmt.
|
| Herstellung
1933
gelang
dem Chemiker Tadeus Reichstein (1897-1996) die genaue Ermittlung der
Struktur
des Molekül-Aufbaus und damit auch die künstliche Herstellung.
Er erhielt dafür 1950 den Nobelpreis für Medizin. Nach seinem
biochemischen Verfahren wird das Vitamin C in vielen komplizierten
Schritten aus Traubenzucker hergestellt. In einem dieser Schritte werden
auch Bakterien eingesetzt. D(+)-Glucose wird zunächst zu
Sorbit reduziert und anschließend mit Sorbose-Bakterien zu dem Kohlenhydrat
L(-)-Sorbose oxidiert. Diese wird unter Zugabe von Aceton
weiter oxidiert, wobei nach der anschließenden Abspaltung des Acetons
und einer Wasserabspaltung Ascorbinsäure entsteht.
|
| Verwendung
Ascorbinsäure wird bei Vitamin-C-Mangel verabreicht. Tadeus Reichstein behauptete bis in sein hohes Alter, dass das Vitamin in hoher Dosis vorbeugend gegen Krebs wirken soll. Daran glaubte auch der Nobelpreisträger Linus Pauling. Allerdings ist diese Behauptung nicht wissenschaftlich belegt. Die Verwendung in Nahrungsmittel-Konserven als Lebensmittel-Zusatzstoff („Anti-Oxidans“) verhindert die Verwesung, deshalb wird das Vitamin im großen Umfang als Konservierungsstoff E 300 eingesetzt, zum Beispiel in Champignon-Konserven. Außerdem verhindert es die oxidative Braunverfärbung bei der Lagerung von Lebensmitteln. Nachweis von Vitamin C Die Ascorbinsäure ist ein starkes Reduktionsmittel. Aus diesem Grund verlaufen die Fehling-Probe, die Tollens-Probe und die Probe mit Benedict Reagenz positiv. Der chemische Nachweis kann mit Tillmans Reagenz (2,6-Dichlorphenolindophenol Natriumsalz) erfolgen: Zum qualitativen Nachweis in der Schule stellt man eine wässrige Reagenz-Lösung mit der ungefähren Konzentration 0,01 mol/l her: Es werden 0,3 g Tillmans Reagenz in 100 ml destilliertem Wasser gelöst. Ein Reagenzglas wird nun mit 3 ml destilliertem Wasser gefüllt. Dann tropft man 3 Tropfen der Reagenz-Lösung in das Wasser und schüttelt leicht. Es entsteht eine cobaltblaue, homogene Lösung. Nach Zugabe von wenig Ascorbinsäure entfärbt sich die Lösung.  Nach der Zugabe der Ascorbinsäure entfärbt sich Tillmans Reagenz-Lösung. Die Ascorbinsäure reduziert Tillmans Reagenz zu einer farblosen Leuko-Verbindung. Mit dieser Methode kann man auch Vitamin C im Zitronensaft nachweisen. Dabei entsteht in einem Zwischenschritt eine rosa Färbung, da Tillmans Reagenz ein Indikator für Säuren ist.  Nach der Zugabe von Zitronensaft entsteht vor der Entfärbung eine rosa Färbung. Mit Hilfe einer Redox-Titration kann man die Vitamin-C-Konzentration bestimmen. Eine Maßlösung mit Tillmans Reagenz wird in eine Bürette gegeben, mit der man die zu bestimmende Vitamin-C-Lösung titriert. Dabei reagiert ein Mol (wasserfreies) Tillmans Reagenz mit einem Mol Ascorbinsäure, weil beide Protonen von einem Molekül Ascorbinsäure aus den beiden OH-Gruppen an der C-C-Doppelbindung im Ring geliefert werden. Diese quantitative Analyse erfordert sehr genaues Arbeiten. 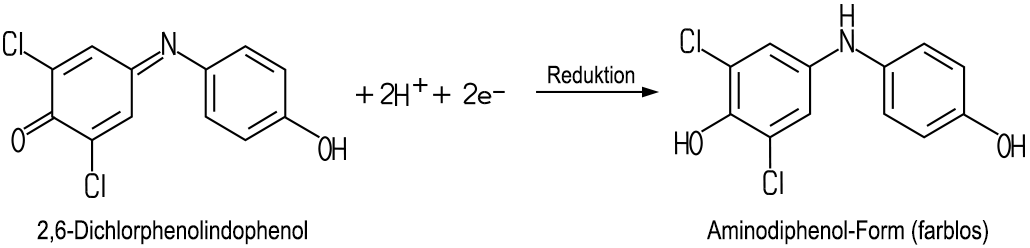 Es ist zu beachten, dass die Nachweis-Reaktion mit Tillmans Reagenz nicht spezifisch ist, auch andere Stoffe mit einem ähnlich hohen Reduktionsvermögen geben eine positive Reaktion. Dies täuscht oft einen viel zu hohen Vitamin-C-Gehalt in Nahrungsmitteln vor. Eine andere und bessere Möglichkeit wäre der Nachweis mit 2,4-Dinitrophenylhydrazin. Da die Chemikalie in trockenem Zustand explosionsgefährlich ist, eignet sich diese Methode nicht für Schulen. Im Handel sind Nachweis-Stäbchen für Vitamin C erhältlich. Mit diesen kann man den Vitamin-C-Gehalt in Nahrungsmitteln grob bestimmen. |
