 |
 Weißes, kristallines Pulver Vorkommen Spierstaude, Kamillenblüten, etherische Öle, Baumrinden |
Molmasse 138,121 g/mol AGW keine Angaben Dichte 1,443 g/cm3 Schmelzpunkt +158,6 °C Siedepunkt +211 °C Wasserlöslichkeit Konz. bei 20 °C 2 g/l Explosionsgrz. min. 15 g/m3 (Luft) Flammpunkt +157 °C Zündpunkt +570 °C |
| Piktogramme GHS 05 GHS 07 GHS 08 Gefahr |
Gefahrenklassen
+ Kategorie Akute Toxizität oral 4 Schwere Augenschädigung 1 Reproduktionstoxizität D 2 |
HP-Sätze (siehe auch Hinweis) H 302, 318, 361d P 280.1-3+7, 301+312, 305+351+338, 310 Entsorgung G 3 |
| Etikett drucken | Dt. Bezeichnung Synonyme (deutsch) |
Engl. Bezeichnung Synonyme (engl.) |
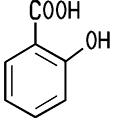
| CAS 69-72-7 | Salicylsäure 2-Hydroxybenzolcarbonsäure |
Salicylic acid 2-Hydroxybenzoic acid |
|
Bemerkungen für Schulen: Salicylsäure kann schwere Augenschäden verursachen. Schutzbrille
und Schutzhandschuhe müssen getragen werden. Aufgrund
der möglichen reprotoxischen Wirkung (Kategorie D 2) wird
empfohlen, nur mit erfahrenen Praktikumsteilnehmern Versuche
durchzuführen. Werdende oder stillende Mütter dürfen mit
diesem Stoff nicht arbeiten. Salicylsäure und ihre Salze zählen zu den ototoxischen Stoffen: Diese können das Innenohr schädigen und Tinnitus, Schwindel oder Gleichgewichtsstörungen auslösen. Die Schädigung ist in der Regel reversibel, solange die Exposition nur einmalig erfolgt ist.
Eigenschaften Salicylsäure
bildet
nadelige, farblose und geruchlose Kristalle. Das
kristalline Pulver erscheint weiß. Es schmeckt süß bis
säuerlich und hat einen unangenehmen Nachgeschmack. Die
Salicylsäure wirkt noch
stärker bakterientötend als Benzoesäure und Phenol. Auf der Haut löst sie allmählich
die Hornhaut auf. Salicylsäure wirkt auch schmerz- und fiebersenkend.
 Salicylsäure ist in kaltem Wasser schwer, in heißem Wasser dagegen gut löslich.
In Ethylalkohol, Diethylether und Aceton löst sie sich ebenfalls gut.
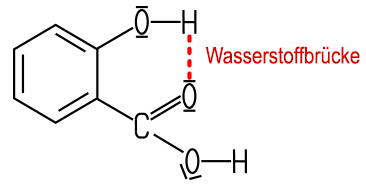
Die Hydroxycarbonsäure ist
eine deutlich stärkere Säure als Benzoesäure.
Mit Eisen(III)-chlorid bildet sich eine typische,
blauviolette Farbreaktion. Beide Merkmale lassen sich auf eine Wasserstoffbrücke
innerhalb des Moleküls zurückführen:
 Beim Erhitzen auf 200°C
entsteht unter Abgabe von Kohlenstoffdioxid Phenol,
oberhalb 250°C reagiert Salicylsäure in einer Kondensationsreaktion
unter Abgabe von Wasser zu Xanthon. Mit Methanol reagiert sie bei der Gegenwart von Schwefelsäure zu Salicylsäuremethylester. Der
entstehende Ester findet sich im Wintergrünöl,
das aus einer in Nordamerika beheimateten Staude gewonnen wird. Die bei
der Reaktion mit sämtlichen Alkoholen zugänglichen Ester der
Salicylsäure dienen als Rheumamittel und aufgrund ihres intensiven
Geruchs auch für die Parfümherstellung. Vor der Entwicklung der
Acetylsalicylsäure diente die Salicylsäure als Mittel gegen Kopfschmerzen und
zur Fiebersenkung. Man verwendete einen Aufguss der Spierstauden-Blüten.
Aufgrund der Nebenwirkungen wird die Salicylsäure für diesen
Zweck nicht mehr verwendet. |
| |
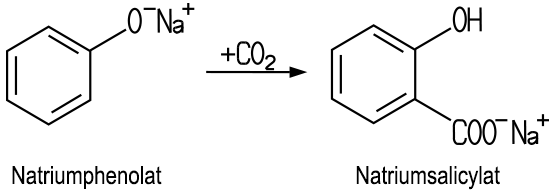
| Herstellung Die Herstellung der Salicylsäure
erfolgt nach der Kolbe-Schmitt-Synthese. Hierbei wirkt Kohlenstoffdioxid auf trockenes Natriumphenolat bei etwa 130 °C und hohem Druck ein. Bei der Reaktion erhält man
Natriumsalicylat, ein Salz der Salicylsäure,
das durch die Zugabe von Säure sehr reine Salicylsäure
liefert:
 |
| Verwendung Die bedeutendste Verwendung ist die Herstellung der Acetylsalicylsäure,
die unter dem Kurznamen ASS oder unter dem Markennamen Aspirin der
Firma Bayer als Fieber- und Schmerzmittel weltweit bekannt ist.
Salicylsäure
wird auch zur Herstellung von Farbstoffen oder als
Desinfektionsmittel und zur Konservierung von Salben,
Tinten und Leimen benötigt. Sie ist nicht als
Lebensmittelzusatzstoff zugelassen.
Salicylsäure und Salicylate sind in vielen kosmetischen Produkten enthalten, zum Beispiel auch in Reinigungsgels, in Anti-Schuppen-Shampoos, in schmerzlindernden Salben oder in hornhautlösenden Mitteln zum Abtragen von Hornhaut oder Warzen. Die Ester der Salicylsäure werden bei der Herstellung von Sonnenschutzmitteln und Duftstoffen eingesetzt. Bei der Veresterung von Salicylsäure mit Methanol und wenig konzentrierter Schwefelsäure als Katalysator erhält man Salicylsäuremethylester, der auch als Wintergrünöl oder als Gaultheriaöl bekannt ist. Dieser Ester kann durch Wasserdampfdestillation aus den Blättern der Pflanzengattungen Wintergrün Pyrola oder Scheinbeeren Gaultheria gewonnen werden. Er wird in Salben als durchblutungsförderndes Mittel eingesetzt. In den USA ist die Geschmacksrichtung „Wintergreen“ ein Bestandteil von Kaugummis. Allerdings sind diese Anwendungen problematisch, da Wintergrünöl das Kind im Mutterleib schädigen kann und sowohl toxisch als auch ototoxisch wirkt. Es wird über die Haut aufgenommen. |