

|
Farbloses Gas mit an faulem Heu oder Obst erinnerndem Geruch |
Molmasse
98,916 g/mol
AGW 0,1 ml/m3 oder 410 µg/m³ (TRGS 900) Dichte 4,531 g/l (Gas, 0°C, 1013 hPa) (Phosgen zu Luft = 3,51) Schmelzpunkt −127,77 °C Siedepunkt +7,5 °C Wasserlöslichkeit Zersetzung |
| Piktogramme
GHS 04 GHS 05 GHS 06 Gefahr |
Gefahrenklassen
+ Kategorie
Gase unter Druck, verdicht. Gas Akute Toxizität inhalativ 1 Ätz/Reizwirkung auf die Haut 1B Schwere Augenschädigung 1 |
HP-Sätze
(siehe Hinweis)
H 280, 314, 318, 330, EUH071 P 261, 280.1-3+6-7, 303+361+353, 304+340, 305+351+338, 310, 405, 410+403 Entsorgung besondere Hinweise |
| Dt. Bezeichnung
Synonyme (deutsch) |
Engl. Bezeichnung
Synonyme (engl.) |
|
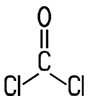
| CAS 75-44-5 | Phosgen
Carbonylchlorid |
Phosgene
Carbonyl chloride |
|
Bemerkung:
Phosgen
darf an Schulen nicht gelagert werden.
Es wird dringend empfohlen, auf Experimente zu verzichten, bei denen
Phosgen entstehen kann. Es handelt sich um ein extrem toxisches Gas.
Beim Einatmen geringer Mengen besteht Lebensgefahr.
Wirkung auf den menschlichen Körper Phosgen ist ein sehr
gefährliches Atemgift, das selbst in geringsten Konzentrationen tödlich
wirkt. Der Geruch des Gases erinnert an faules Heu. Die ersten Vergiftungssymptome
zeigen sich in Atemnot, Husten und Tränenreiz. Der Tod tritt durch
ein Lungenödem und durch Herzstillstand ein. Hierbei tritt Blutflüssigkeit
in die Lungen. Der Tod kann auch noch viele Stunden nach dem Einatmen des
Gases eintreten. Im Vergiftungsfall ist sofortige Ruhelage unbedingt notwendig.
Phosgen wurde im Ersten Weltkrieg als Kampfgas Grünkreuz
eingesetzt.
|
| Eigenschaften
Phosgen ist ein farbloses
Gas, das bei Abkühlung auf 7 °C zu einer farblosen, leicht beweglichen
Flüssigkeit kondensiert. Phosgen löst sich gut in Benzol, Chloroform,
Tetrachlorkohlenstoff oder in Toluol. Mit Wasser zersetzt es sich langsam
unter Bildung von Kohlenstoffdioxid und Chlorwasserstoff:
COCl2 + H2O Eine Zersetzung findet
auch durch kurzwelliges UV-Licht und beim Erhitzen auf 500 bis 800 °C statt.
Die Chlor-Atome des Phosgens können leicht ersetzt werden, wenn man
Alkohol hinzugibt. Hierbei entstehen Ester der Kohlensäure.
|
| Herstellung
Phosgen
kann im Labor aus Tetrachlorkohlenstoff und rauchender Schwefelsäure dargestellt werden. Bei dieser Reaktion entsteht Phosgen und Chlorsulfonsäure.
CCl4 + SO3 + H2SO4 Die industrielle Gewinnung
erfolgt durch die Reaktion von Chlor mit Kohlenstoffmonooxid bei etwa 110 °C. Dazu benötigt es Aktivkohle als Katalysator:
CO + Cl2 Phosgen kann auch bei
der Verbrennung von chlorhaltigen Kunststoffen oder beim Erhitzen von Chlorkohlenwasserstoffen wie Tetrachlormethan oder Chloroform in Gegenwart von Metallen oder Kohle entstehen.
|
| Verwendung
Phosgen ist ein vielseitiger
Grundstoff zur Herstellung organischer Verbindungen, beispielsweise
zur Chlorierung oder zur Einführung der CO-Gruppe. Mit Ammoniak bildet
sich Harnstoff, mit Aminen Carbamoylchlorid. Daraus lassen sich dann wiederum
Isocyanate herstellen, die als wichtige Zwischenprodukte für Kunststoffe
gelten. Phosgen dient auch als Ausgangsstoff zur Fabrikation von Medikamenten,
Farbstoffen und Insektiziden.
|