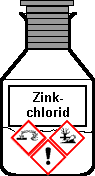
Zinkchlorid ZnCl2
 |
Weißes, kristallines Pulver |
Molmasse 136,315 g/mol
AGW keine Angaben Schmelzpunkt 290 °C Dichte 2,907 g/cm3 Wasserlöslichkeit 100g H2O lösen bei 25 °C 408 g |
| Piktogramme
GHS 05 GHS 09 Gefahr |
Gefahrenklassen
+ Kategorie
Akute Toxizität oral 4 Ätz-/Reizwirkung auf die Haut 1B Gewässergefährdend chron./akut 1 |
HP-Sätze
(siehe Hinweis)
H 302, 314, 400, 410 P 280.1-3, 273, 301+330+331, 305+351+338, 309+310 Entsorgung G 4 |
| Etikett drucken | Deutscher Name | Englischer Name |
| CAS 7646-85-7 | Zinkchlorid | Zinc chloride |
|
Eigenschaften
Zinkchlorid bildet ein
weißes, kristallines Pulver, das an der Luft sehr schnell Wasser
anzieht und dabei zerfließt. Das Salz ist äußerst gut
löslich in Wasser, sowie in organischen Lösungsmitteln wie
Ethanol, Aceton oder Diethylether. Das Produkt beim Auflösen in
Wasser reagiert stark sauer. Mit Wasser bildet sich bei höheren
Konzentrationen Chlorohydroxozinksäure:
ZnCl2 + 2 H2O Dies erklärt auch die ätzende Wirkung des Salzes, wenn es mit feuchter Haut oder mit der Augenflüssigkeit in Kontakt kommt. Hoch konzentrierte Lösungen können sogar organische Stoffe wie Holz zerstören, das ähnlich wie bei der Behandlung mit konzentrierter Schwefelsäure verkohlt.  Zinkchlorid zerfließt an der Luft, da es Wasser anzieht. Die Lösung reagiert sauer. |
|
Herstellung
Zinkchlorid könnte man direkt aus den Elementen Zink und Chlor herstellen. Die chemische Industrie stellt es aber aus Zink oder Zinkoxid und Salzsäure, meistens mit heißem Chlorwasserstoff her. Verunreinigungen wie Eisen werden danach durch die Zugabe von Chlor beseitigt.
Zinkchlorid herstellen: Zn + 2 HCl Beseitigung des Eisens: 2 Fe + 3 Cl2 |
|
Verwendung
Zinkchlorid stellt in der
Industrie ein vielfältiger Rohstoff dar. Aufgrund der
wasserabspaltenden Wirkung wird es bei vielen organischen Synthesen
benötigt. Es dient zum Imprägnieren von Holz oder zum
Konservieren von Tiermaterial. Die Papierindustrie setzt es zur
Herstellung von Pergamentpapier, zum Leimen und zum Bleichen von Papier
ein. Vermischt man eine konzentrierte Zinkchlorid-Lösung mit
Zinkoxid, erhält man eine zementartige Masse, die als Kitt für
Zähne oder für Metalle geeignet ist. Zinkchlorid wird auch
beim Löten zur Herstellung von Lötwasser oder Lötsalz
benötigt.
|