| Polarität – Zwischenmolekulare Kräfte | ||||||
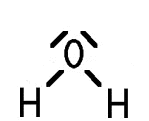
Gibt man mit einer Pipette Wasser in Alkohol, vermischen sich die beiden Flüssigkeiten vollständig. Gibt man Wasser in Olivenöl, nimmt das Wasser kugelige Form an und sammelt sich am Boden. Diese Phänomene lassen sich anhand des Molekülbaus erklären: Die Atome in den Molekülen dieser Stoffe sind durch Elektronenpaarbindungen verknüpft. Wenn die Differenz der Elektronegativität zwischen zwei Bindungspartnern in einer Elektronenpaarbindung zwar kleiner als 1,7, aber dennoch höher als 0,4 ist (grober Richtwert), so zieht das elektronegativere Atom die gemeinsam genutzten Elektronen stärker an. Dann entsteht eine polare Elektronenpaarbindung. Ein typisches Beispiel hierfür ist das Wasser-Molekül.
Ob ein Molekül insgesamt polar ist, hängt nicht nur von der Polarität einzelner Bindungen, sondern auch von der räumlichen Anordnung der Atome ab. Das Wasser-Molekül ist gewinkelt; der Bindungswinkel zwischen den beiden O–H-Bindungen beträgt 104,45°. Aufgrund dieser Geometrie heben sich die Ladungsverschiebungen nicht auf.
 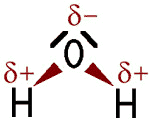
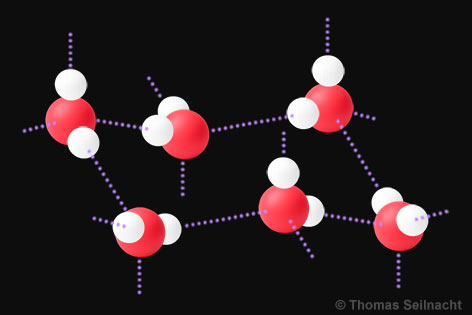
Im Wasser-Molekül zieht das elektronegativere Sauerstoff-Atom die Bindungselektronen stärker an und trägt daher eine partielle negative Ladung (δ−, gesprochen „delta minus“), während die beiden Wasserstoff-Atome partiell positiv geladen sind (δ+, gesprochen „delta plus“). Die Polarität beschreibt diese ungleiche Ladung, die durch unterschiedliche Elektronegativitäten der beteiligten Atome entsteht. Ein polares Molekül wie das Wasser-Molekül wird als Dipol bezeichnet. Ein Dipol bzw. die Polarität erhöhen die Siedetemperatur und auch die Löslichkeit polarer Stoffe untereinander, weil zwischen den Molekülen stärkere Anziehungskräfte wirken. Ein Ethanol-Molekül ist an seiner Hydroxy-Gruppe (OH) ebenfalls polar. Polare Stoffe sind untereinander löslich. Die Moleküle der Fettsäuren, die im Olivenöl enthalten sind, sind nicht polar. Deshalb vermischen sich Wasser und Olivenöl nicht, sie sind nicht ineinander löslich.
Das H2S-Molekül ist zwar auch gewinkelt, aber die EN-Differenz zwischen Wasserstoff- und Schwefel-Atom beträgt nur 0,4, das Molekül ist nur ganz schwach polar, daher liegt Schwefelwasserstoff bei Raumtemperatur gasförmig vor. Obwohl C=O-Bindungen an sich polar sind, bildet das CO2-Molekül keinen Dipol. Der Grund liegt darin, dass die O=C=O-Bindung linear aufgebaut ist, die Sauerstoff-Atome liegen gegenüber auf einer Linie. Dadurch heben sich die Ladungsverschiebungen vollständig auf. Induktiver Effekt Die Ladungsverschiebung kann sich auch entlang benachbarter Bindungen fortsetzen. Dieser Einfluss eines Atoms oder einer Atomgruppe auf die Elektronenverteilung innerhalb eines Moleküls wird als induktiver Effekt bezeichnet. Dabei nimmt die Stärke des Effekts mit zunehmender Entfernung vom verursachenden Atom oder der Atomgruppe ab. Der induktive Effekt kann elektronenanziehend sein (−I-Effekt) oder elektronenschiebend (+I-Effekt). Atomgruppen mit hoher Elektronegativität wie Halogen-Atome (Cl, Br), sauerstoffhaltige Gruppen (OH, COOH) oder die Nitrogruppe (–NO2) ziehen Elektronen an sich heran. Dadurch verringern sie die Elektronendichte an benachbarten Atomen (−I-Effekt). Alkylgruppen (–CH3, –C2H5) schieben die Elektronendichte in Richtung benachbarter Atome (+I-Effekt). Für chemische Reaktionen ist der induktive Effekt von besonderer Bedeutung, da er bestimmt, wo im Molekül Elektronenmangel oder Elektronenüberschuss vorliegt. Dadurch lassen sich bevorzugte Reaktionsstellen erkennen. Atome oder Atomgruppen mit verringerter Elektronendichte reagieren leichter mit elektronenreichen Reaktionspartnern, während Bereiche mit erhöhter Elektronendichte bevorzugt mit elektronenarmen Partnern reagieren. Mehr Elektronendichte kann aber auch die Abgabe von Protonen erschweren, zum Beispiel bei Carbonsäuren. Der +I-Effekt erklärt zum Beispiel, warum die kurzkettigen Alkansäuren eine höhere Säurestärke aufweisen als die langkettigen. Zwischenmolekulare Kräfte 1. Van-der-Waals-Kräfte Van-der-Waals-Kräfte sind schwache Anziehungskräfte zwischen Molekülen. Sie wurden nach dem niederländischen Physiker Johannes Diderik van der Waals (1837–1923) benannt, der diese schwachen Anziehungskräfte zwischen Molekülen als Erster erkannte. Sie wirken nicht innerhalb eines Moleküls, sondern nur, wenn sich Moleküle nahekommen. In der Natur nutzen zum Beispiel die Geckos diese Kraft, in dem ihre Fußunterseiten mit extrem feinen Lamellen versehen sind. Dadurch haben die Füße eine extrem große Oberfläche und die Lamellen sind extrem nahe an der Kontaktfläche. Der Abstand beträgt nur 0,3 nm, er liegt im Nanobereich. Die Haftung ist ein Ergebnis der Van-der-Waals-Kräfte, die zwischen den Keratinmolekülen in den Faser-Eiweißen der Härchen und dem Untergrund wirken. Die Ursache der Van-der-Waals-Kräfte liegt darin, dass die Elektronen in Atomen und Molekülen ständig in Bewegung sind. Dadurch ist die elektrische Ladung eines Moleküls nicht zu jedem Zeitpunkt gleichmäßig verteilt. Wenn sich zwei Moleküle nahe sind, können solche kurzfristigen Ladungsunterschiede dazu führen, dass sich die Moleküle gegenseitig schwach anziehen. Diese Anziehung ist nur von kurzer Dauer und deutlich schwächer als chemische Bindungen. Trotzdem hat sie einen großen Einfluss auf die Stoffeigenschaften. Van-der-Waals-Kräfte wirken bei allen Molekülen, sind aber besonders wichtig bei unpolaren Stoffen, da dort keine stärkeren zwischenmolekularen Kräfte vorhanden sind. 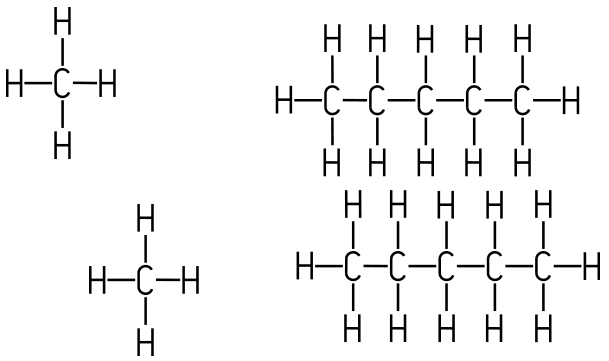 Methan-Molekül (links), Pentan-Molekül (rechts). Beispiel: Kurzkettige Alkane wie Methan oder Ethan sind bei Raumtemperatur gasförmig. Mit zunehmender Kettenlänge steigen die Siedepunkte der Alkane, ab dem Pentan sind sie flüssig und langkettige Alkane sind sogar fest. Der Grund dafür ist, dass größere Moleküle stärkere Van-der-Waals-Kräfte ausüben, da sie eine größere Berührungsfläche besitzen. Mit zunehmender Verzweigung der Alkane nimmt die Stärke der Van-der-Waals-Kräfte ab, da die „Kontaktfläche“ zwischen den Molekülen kleiner wird. Deshalb hat ein gesättigtes, verzweigtes Alkan mit gleicher Summenformel einen niedrigeren Siedepunkt als ein unverzweigtes.
 Die helle Kappe am vorderen Tropfen kommt durch Lichtreflexe zustande. 2. Wasserstoffbrückenbindungen Die beiden Wassertropfen auf dem Paraffin bilden kugelige Formen und zerfließen nicht, wie dies auf einer Glasscheibe der Fall wäre. Warum ist das so? Die gegensätzlichen Ladungen zwischen den polaren Wasser-Molekülen ziehen sich gegenseitig an, es entstehen Wasserstoffbrückenbindungen als zwischenmolekulare Kräfte. Im Innern der Flüssigkeit ist jedes Wasser-Molekül von einem anderen Molekül umgeben. Daher heben sich die Kräfte gegenseitig auf. Anders verhält es sich an der Grenzfläche zwischen Wasser und Luft. An der Oberfläche des Wassers wirken die Kräfte einseitig. Da die Wasser-Moleküle hier nach oben keine Nachbarn haben, resultiert daraus eine Kraft, die in das Innere der Flüssigkeit senkrecht gerichtet ist. Zum Ausgleich bildet daher ein Wassertropfen im Idealzustand beim freien Fall die Kugelform aus. Die Kugelform bildet die kleinstmögliche Oberfläche. Liegt der Tropfen auf einem Untergrund, wirken weitere Kräfte – beispielsweise die Schwerkraft – auf den Wassertropfen ein. So entsteht die typische, eingedellte Tropfenform eines liegenden Wassertropfens. Wasserstoffbrückenbindungen (auch „Wasserstoffbrücken“) wirken stärker als Van-der-Waals-Kräfte und tragen – wie Dipol-Dipol-Wechselwirkungen – zur Erhöhung der Siedepunkte und der Löslichkeit in polaren Lösungsmitteln bei. Die Stärke zwischenmolekularer Anziehungskräfte kann unterschiedlich groß sein. Sie lässt sich vereinfachend so ordnen: Van-der-Waals-Kräfte < Dipol-Dipol-Wechselwirkungen < Wasserstoffbrückenbindungen Wasserstoffbrückenbindungen erklären viele ungewöhnliche Stoffeigenschaften, vor allem bei Wasser, Alkoholen und anderen Stoffen mit O–H- oder N–H-Gruppen. Damit Wasserstoffbrückenbindungen entstehen können, müssen zwei Bedingungen erfüllt sein: 1. Es wird ein Wasserstoff-Atom als Donor benötigt, das mit einem geeigneten und stark elektronegativen Atom kovalent gebunden ist (O–H, N–H, H-F). Dann zieht das elektronegative Atom die Bindungselektronen stark an. Das Wasserstoff-Atom wird dadurch deutlich partiell positiv (δ⁺). 2. Es wird auch ein Akzeptor mit mindestens einem freien Elektronenpaar benötigt, zum Beispiel stark elektronegative Atome (O, N, F) in Molekülen oder Ionen. Die zwischenmolekularen Bindungskräfte einer Wasserstoffbrückenbindung werden mit einer gestrichelten Linie gezeichnet, zum Beispiel O–H···|O oder O–H···|N. 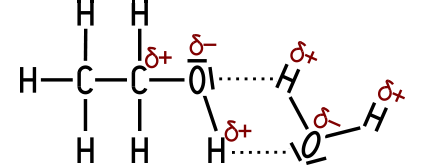 Wasserstoffbrückenbindungen zwischen einem Ethanol- und einem Wasser-Molekül. Wasserstoffbrückenbindungen führen zu einer höheren Siedetemperatur, sie erhöhen die Oberflächenspannung beim Wasser und verursachen gute Lösungseigenschaften für viele polare Stoffe und Ionen. Beispiel 1: Ethanol besitzt eine O–H-Gruppe und kann Wasserstoffbrückenbindungen bilden – sowohl zwischen den Ethanol-Molekülen untereinander sowie zwischen Ethanol- und Wasser-Molekülen. Deshalb hat Ethanol eine viel höhere Siedetemperatur als Ethan. Ethanol ist mit Wasser unbegrenzt mischbar, während Ethan kaum wasserlöslich ist. Paraffin ist ein langkettiges Alkan und ist wie Ethan unpolar. Beispiel 2: Carbonsäuren wie die Ethansäure besitzen ebenfalls eine O–H-Gruppe und ein stark elektronegatives Sauerstoff-Atom in der Carbonylgruppe. Sie können besonders effektiv Wasserstoffbrückenbindungen bilden und liegen häufig als Dimere vor (zwei Moleküle „paaren“ sich). Deshalb besitzen sie relativ hohe Siedetemperaturen und charakteristische Eigenschaften, zum Beispiel haben sie eine geringere Flüchtigkeit als vergleichbare Stoffe. Wovon hängt die Wasserlöslichkeit ab? Die Wasserlöslichkeit eines Stoffes hängt vor allem ab von (a) der Polarität des Moleküls, (b) der Art der zwischenmolekularen Wechselwirkungen und (c) dem Verhältnis von polarem zu unpolarem Molekülanteil. Übungsbeispiel: Alle Alkohole besitzen mindestens eine Hydroxy-Gruppe, ihre Moleküle unterscheiden sich aber unter anderem in ihrer Kettenlänge. Begründe, warum die Wasserlöslichkeit mit zunehmender Kettenlänge abnimmt! 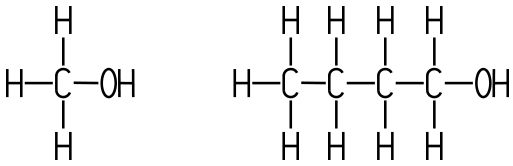 Methanol (links) und Butanol (rechts).
Antwort: Alle Alkohole besitzen eine stark polare O–H-Gruppe, die Wasserstoffbrückenbindungen mit Wasser eingehen kann. Der Alkyl-Rest ist jedoch unpolar. Mit zunehmender Länge des Alkyl-Rests nimmt der unpolare Anteil im Verhältnis zum polaren Anteil im Molekül zu, so dass die Wechselwirkungen mit den Wasser-Molekülen gestört werden. Die Van-der-Waals-Kräfte zwischen den größeren Molekülen verstärken den Effekt, allerdings nur zu einem relativ geringen Anteil.
Ergebnis: Die Wasserlöslichkeit steigt mit der zunehmenden Polarität eines Moleküls und mit seiner Fähigkeit, Wasserstoffbrückenbindungen mit Wasser auszubilden, während große unpolare Molekülanteile die Wasserlöslichkeit verringern. Wovon hängt der Siedepunkt ab? Der Siedepunkt eines Stoffes hängt vor allem ab von (a) der Stärke der zwischenmolekularen Kräfte, (b) der Molekülgröße und Oberfläche und (c) der Molekülstruktur. Übungsbeispiel 1: Begründe, warum Wasser (H2O) einen höheren Siedepunkt hat als Schwefelwasserstoff (H2S, Siedepunkt −60 °C)? Antwort: Die Wasser-Moleküle bilden viele Wasserstoffbrückenbindungen untereinander. Durch diese zwischenmolekularen Kräfte wird der Siedepunkt erhöht. Die Schwefelwasserstoff-Moleküle sind kaum polar, sie können keine wirksamen Wasserstoffbrücken ausbilden, sie besitzen aufgrund ihrer relativ geringen Größe nur schwache Van-der-Waals-Kräfte. Diese Kombination führt zu einem relativ niedrigen Siedepunkt, so dass Schwefelwasserstoff bei Raumtemperatur gasförmig ist. Übungsbeispiel 2: Die beiden Stoffe 1-Butanol und 2-Methyl-2-propanol (tert. Butanol) sind Konstitutions-Isomere, sie haben die gleiche Summenformel (C4H10O). Begründe, warum einer der beiden Stoffe mit 117 °C einen höheren Siedepunkt hat, während der andere Stoff mit 82 °C einen niedrigeren Siedepunkt hat. Welcher der Stoffe ist besser wasserlöslich und warum? 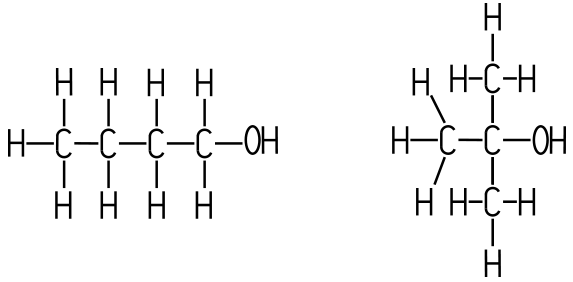 1-Butanol (links) und 2-Methyl-2-propanol oder tert. Butanol (rechts).
Antwort: Beide Stoffe zählen zu den Alkoholen und enthalten pro Molekül eine Hydroxy-Gruppe, daher können sie Wasserstoffbrückenbindungen ausbilden, was grundsätzlich den Siedepunkt erhöht. Beim 1-Butanol ist das Molekül unverzweigt und langgestreckt, dies führt zu starken Van-der-Waals-Kräften zwischen den Molekülen. Dies erhöht den Siedepunkt zusätzlich. Beim tert-Butanol ist das Molekül stark verzweigt und kompakt. Dadurch ist die Kontaktfläche zwischen den Molekülen kleiner, wodurch die Van-der-Waals-Kräfte deutlich schwächer wirken. Trotz der vorhandenen Wasserstoffbrücken ist der Siedepunkt daher deutlich niedriger. tert-Butanol ist besser wasserlöslich als 1-Butanol, weil der Alkylrest kompakter ist und die OH-Gruppe dadurch Wasserstoffbrückenbindungen mit Wasser-Molekülen besser ausbilden kann.
Ergebnis: Der Siedepunkt eines Stoffes steigt mit der Stärke der zwischenmolekularen Kräfte, insbesondere durch Wasserstoffbrückenbindungen und zunehmende Van-der-Waals-Kräfte. Wasserstoffbrücken in Feststoffen Viele organische Stoffe bilden im festen Zustand regelmäßig geordnete Strukturen. Auf molekularer Ebene können die einzelnen Moleküle durch Wasserstoffbrücken miteinander verknüpft sein. Dies führt zu einem stabilen und regelmäßigen Netzwerk zwischen vielen Molekülen. Wenn das Netzwerk besonders stabil ist, dann kann das dazu führen, dass ein solcher Stoff nicht wasserlöslich ist, dies ist zum Beispiel bei der Cellulose der Fall. Wasserstoffbrücken verstärken den Zusammenhalt zwischen den Molekülen, so dass zum Schmelzen (und zum Verdampfen) mehr Energie benötigt wird. Dadurch liegen sowohl der Schmelzpunkt (als auch der Siedepunkt) höher als bei vergleichbaren Stoffen ohne Wasserstoffbrücken. Auch in einem Eiskristall werden die Wassermoleküle durch Wasserstoffbrücken zusammengehalten. Jedes Wassermolekül kann bis zu vier Wasserstoffbrücken zu benachbarten Molekülen ausbilden. Die tetraedrische Anordnung der Wasserstoffbrücken im Eis führt zu einem Netzwerk, in dem sechsgliedrige Ringe mit hexagonaler Symmetrie energetisch bevorzugt sind. Die durch Wasserstoffbrücken im Eis erzwungene starre Struktur des Eisgitters verhindert die Wirkung der Van-der-Waals-Kräfte und erzwingt größere mittlere Abstände zwischen den Wassermolekülen und verursacht damit eine geringere Dichte, weshalb Eis auf dem Wasser schwimmt. Aufgrund der geringeren Dichte des Eises mit 0,917 g/cm³ schwimmt ein Eisberg auf dem Wasser. Er taucht zu 89,5 Volumenprozent unter Wasser, es sind nur wenig mehr als 10 % des gesamten Eisberges über dem Wasser sichtbar. Dies wurde der Titanic zum Verhängnis. Es gilt das archimedische Prinzip: Ein Körper verdrängt genau so viel Flüssigkeit, wie seiner Masse entspricht. Zucker besitzen zahlreiche Hydroxy-Gruppen. Zwischen diesen Gruppen entstehen viele Wasserstoffbrücken, sowohl zwischen benachbarten Zuckermolekülen im Feststoff als auch zwischen Zucker und Wassermolekülen in Lösung. Diese Wasserstoffbrücken erklären, warum Zucker kristallisieren können, gleichzeitig aber gut wasserlöslich sind. Bei Proteinen sind Wasserstoffbrücken entscheidend für die räumliche Struktur. Die typische Sekundärstruktur bei der α-Helix und beim β-Faltblatt wird durch Wasserstoffbrücken zwischen den Peptidgruppen stabilisiert; in der α-Helix entstehen sie innerhalb derselben Polypeptidkette, im β-Faltblatt zwischen benachbarten Kettenabschnitten. Ohne Wasserstoffbrücken könnten Proteine ihre charakteristische Form und damit ihre biologische Funktion nicht einnehmen. Auch die Struktur der DNA beruht auf Wasserstoffbrücken. Die beiden Stränge der Doppelhelix werden durch Wasserstoffbrücken zwischen den jeweils komplementären Basen zusammengehalten. Diese Bindungen sind stark genug, um die Struktur zu stabilisieren, aber gleichzeitig schwach genug, um bei der Zellteilung oder der Proteinsynthese wieder gelöst zu werden. Cellulose ist ein Makromolekül, das aus vielen Cellobiose-Bausteinen aufgebaut ist. Zwischen den zahlreichen Hydroxy-Gruppen der Cellulose-Ketten entstehen viele Wasserstoffbrücken, sowohl innerhalb einer Kette als auch zwischen benachbarten Ketten. Diese Wasserstoffbrücken vernetzen die Moleküle zu festen Faserstrukturen. Dadurch erklärt sich die hohe Festigkeit von Holz und Baumwolle sowie die geringe Wasserlöslichkeit von Cellulose, obwohl sie aus Zuckereinheiten aufgebaut ist. Buch individuell erstellen: Basis-Text Polarität und zwischenmolekulare Kräfte |