zur Gewinnung von Natrium, Lithium und Chlor
Der englische Chemiker
Humphry Davy (1778–1829) führte
im Jahr 1807 als Erster eine Schmelzflusselektrolyse durch. So konnte er
das Element Kalium aus Kaliumhydroxid gewinnen.
Das Natrium erhielt er durch eine Schmelzflusselektrolyse
von Natriumhydroxid in einer Platinschale. Ein daran anknüpfender
Versuch ist in einigen Experimentierbüchern beschrieben. Im Unterricht
wird häufig die Schmelzflusselektrolyse von Zinkbromid
durchgeführt, um zu zeigen, dass hierbei Bromdämpfe und ein Zinkbaum
an einer Elektrode entstehen. [Literatur 1]
Das Prinzip beruht darauf, das elektrisch geladene Ionen in Salzschmelzen
frei beweglich sind und diese durch elektrischen Strom oxidiert oder reduziert
werden können. Die Alkalimetalle Kalium, Rubidium und Caesium stellt
man dagegen durch eine Reduktion mit anderen Metallen dar. Die Herstellung
von Kalium gelingt beispielsweise durch eine Reduktion von Kaliumchlorid
mit Natrium. [Literatur 2]
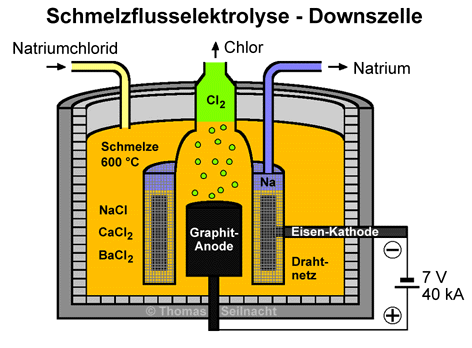
Natrium
oder Lithium werden heute durch eine Schmelzflusselektrolyse
von Natrium- oder Lithiumchlorid in einer Downszelle gewonnen. Dieses Verfahren
geht auf ein Patent aus dem Jahr 1902 zurück, das James C. Downs anmeldete.
[Literatur 5]
Als Flussmittel zum Herabsetzen des Schmelzpunktes auf etwa 600 °C werden
Calciumchlorid CaCl2 und Bariumchlorid BaCl2 verwendet. In der Schmelze einer Downszelle befinden sich 30 bis 40% Massenanteile
Natriumchlorid und 60 bis 70% Anteile
des Flussmittelgemisches. Die Elektrolysezelle besteht aus einem Stahlbehälter,
der innen mit Steinen ausgemauert ist. Die Anode aus Graphit ist ringförmig
von einer Eisen-Kathode umgeben. Die Temperatur der Schmelze liegt bei
etwa 600 °C, die Elektrolyse erfolgt bei etwa sieben Volt und Stromstärken
von mehr als 40000 Ampere. [Literatur 2
und 3] Eine Glocke aus Nickel
fängt das an der Graphit-Anode entstehende Chlor
auf. An der Glocke hängt ein Drahtnetz als Diaphragma. Dieses trennt
das Chlorgas vom entstehenden Natrium und verhindert die potenziell heftige
Rückreaktion. Das flüssige Natrium
sammelt sich oben im Diaphragma, es wird durch ein eisernes Steigrohr entnommen.
Zur Herstellung von einer Tonne Natrium werden etwa 2,6 Tonnen Natriumchlorid
und 10000 Kilowattstunden elektrische Energie benötigt. [Literatur
3] Das gewonnene Natrium
wird in beheizbaren Waggons oder Containern transportiert und zur Weiterverarbeitung
unter Paraffinöl geschmolzen. [Literatur 4]
Reaktionsgleichung
| Reduktion an der Kathode | 2 Na+
+ 2e− |
| Oxidation an der Anode | 2 Cl− |
| Gesamtreaktion | 2 NaCl |
Die positiv geladenen
Natrium-Ionen wandern zur negativ geladenen Eisen-Kathode, sie nehmen Elektronen
auf und werden zu Natrium-Atomen reduziert. Die negativ geladenen Chlorid-Ionen
wandern in der Schmelze zur positiv geladenen Graphit-Anode. Sie geben
Elektronen ab und werden zu Chlor-Atomen oxidiert.
Literatur
Literatur
1
Seilnacht/Rehm (2009): Chemische Experimente
erleben, Buch + 4 DVDs, Bern
2 Hollemann/Wiberg (2007): Lehrbuch der anorganischen Chemie, Berlin/New York
3 Binder (1999): Lexikon der chemischen Elemente, Stuttgart/Leipzig
4 Roempp (1995): Chemielexikon, Stuttgart
5 Glöckner/Jansen u.a. (1994): Handbuch der experimentellen Chemie, Band 2 Alkali- und Erdalkalimetalle, Köln
2 Hollemann/Wiberg (2007): Lehrbuch der anorganischen Chemie, Berlin/New York
3 Binder (1999): Lexikon der chemischen Elemente, Stuttgart/Leipzig
4 Roempp (1995): Chemielexikon, Stuttgart
5 Glöckner/Jansen u.a. (1994): Handbuch der experimentellen Chemie, Band 2 Alkali- und Erdalkalimetalle, Köln