 |
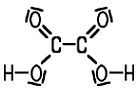 Farblose, prismatische Kristalle Vorkommen Pflanzen (Sauerklee, Sauerampfer, Rhabarber), im Harn |
Molmasse 90,035 g/mol (Dihydrat 126,065 g/mol) AGW 1 mg/m3 E (TRGS 900) Dichte 1,900 g/cm3 (Dihydrat 1,653 g/cm3) Zersetzung +189,5 °C Wasserlöslichkeit Konz. bei 20 °C 95,1 g/l |
| Piktogramm GHS 05 GHS 07 Gefahr |
Gefahrenklassen
+ Kategorie Akute Toxizität oral/dermal 4 Schwere Augenschädigung 1 |
HP-Sätze (siehe Hinweis) H 302, 312, 318 P 264, 280.1-3, 301+310, 305+351+338, 302+352 Entsorgung G 3 |
| Etikett drucken | Dt. Bezeichnung Synonyme (deutsch) |
Engl. Bezeichnung Synonyme (engl.) |
| CAS 144-62-7 | Oxalsäure Ethandisäure, Kleesäure |
Oxalic acid Ethanedioic acid |
| CAS 6153-56-6 | Oxalsäure Dihydrat * Ethandisäure Dihydrat |
Oxalic acid Dihydrate Ethanedioic acid dihydrate |
*) Für die Schule bevorzugt
| Wirkung auf den menschlichen Körper Oxalsäure und
ihre
Salze reizen Haut und Schleimhäute. Bei der inneren Einnahme treten
Erbrechen und Durchfall, sowie Krämpfe auf. Auch schwere
Nierenschädigungen
können folgen. Die Giftwirkung beruht auf einer Störung des
Calciumhaushaltes.
Bei einer Oxalurie befindet sich im Harn aufgrund einer
Stoffwechselstörung zu viel Calciumoxalat, dabei bilden sich Blasen-
und Nierensteine.
 Eigenschaften Oxalsäure Dihydrat ist als grobkristallines Pulver erhältlich, das in zerkleinerter Form weiß erscheint. Die farb- und geruchlosen Kristalle kristallisieren nach dem monoklinen System, während das Kaliumsalz Kaliumoxalat Monohydrat nach dem orthorhombischen System kristallisiert. Oxalsäure Dihydrat ist gut in Wasser und in Ethylalkohol löslich. Beim vorsichtigen Erhitzen auf 100 °C erhält man kristallwasserfreie Oxalsäure. Bei zu schnellem Erhitzen oder unter Einwirkung von heißer konzentrierter Schwefelsäure zerfällt Oxalsäure in Sauerstoff, Kohlenstoffmonooxid und Wasser. Der Wald-Sauerklee Oxalis corniculata enthält Oxalsäure und ihre Salze |
| Herstellung Die Oxalsäure wurden
von J.C. Wiegleb (1732–1800) im Sauerklee 1769 entdeckt. Im Jahr 1776 gelang Carl Wilhelm Scheele zusammen mit
Torbern Olof Bergmann (1735–1784) erstmals die Herstellung von Oxalsäure
durch das Einwirken von Salpetersäure auf Zucker. Die erste Synthese
aus anorganischen Stoffen nahm Friedrich
Wöhler im Jahr 1824 aus Dicyan vor. Wöhlers Verfahren besitzt
jedoch keine praktische Bedeutung mehr. Heute kommen zwei Verfahren
zur Anwendung. Beim ersten wird der Zweifachzucker Saccharose mit konzentrierter Salpetersäure in Gegenwart
eines Vanadin(V)-oxid-Katalysators oxidiert:
C12H22O11 + 9 O2 Beim zweiten Verfahren
erhitzt man Natriumformiat, ein Salz der Ameisensäure,
auf 360 °C in Gegenwart von Natriumhydroxid,
wobei unter Wasserstoffentwicklung das Oxalsäuresalz Natriumoxalat
entsteht:
2 H-COONa Durch ein Umsetzung mit Calciumhydroxid erhält man schwerlösliches
Calciumoxalat, aus dem die Oxalsäure mit Schwefelsäure gewonnen werden kann. Die Vorgänge können auch wieder umgekehrt
werden, so dass man aus Oxalsäure Ameisensäure herstellen kann. |
| Verwendung Oxalsäure wird in
der Analytik als Urtitersubstanz zum Einstellen von Permanganat-Maßlösungen eingesetzt. Sie dient in der Färberei als Beizmittel und wird zum Bleichen von Stroh und Stearin verwendet. Man kann mit ihr
Metalle reinigen und Rost entfernen: Sie bildet mit Eisen-Ionen
lösliche Doppelsalze. Da Oxalsäure auch Berliner
Blau löst, eignet sie sich zur Herstellung von Tintenkillern.
Die chemische Industrie benötigt Oxalsäure als Zwischenprodukt
zur Synthese von Oxalaten und Farbstoffen. |