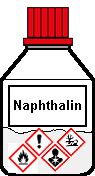
 Teflonverschluss |
 Farblose Kristallblättchen Vorkommen Kohle, Erdöl, Erdgas, Magnolien, Thermiten |
Molmasse 128,171 g/mol AGW 2 mg/m3 (TRGS 900) Dichte 1,0253 g/cm3 Schmelzpunkt +80,22 °C Siedepunkt +218,0 °C Wasserlöslichkeit bei 25 °C 0,0316 g/l Brechungsindex (20°C) 1,5898 Explosionsgrz. 0,9 bis 5,9 Vol.-% (Luft) Flammpunkt +79 °C Zündpunkt +526 °C |
| Piktogramme GHS 02 GHS 07 GHS 08 GHS 09 Gefahr |
Gefahrenklassen
+ Kategorie Entzündbare Feststoffe 1 Akute Toxizität oral 4 Karzinogenität 2 Gewässergefährdend akut 1 Gewässergefährdend chron. 1 |
HP-Sätze (siehe auch Hinweis) H 228, 302, 351, 400, 410 P 210, 261, 273, 280.1-4, 301+310, 501 Entsorgung G 3 |
| Etikett drucken | Dt. Bezeichnung Synonyme (deutsch) |
Engl. Bezeichnung Synonyme (engl.) |
| CAS 91-20-3 | Naphthalin Naphthalen |
Naphthalene |
Bemerkung
für Schulen: Naphthalin ist ein krebserzeugender
Stoff der Kategorie 2. Es ist leicht entzündbar und sublimiert
schon bei Raumtemperatur. Es wird empfohlen, diesen Stoff an Schulen
nicht aufzubewahren.
Wirkung auf den menschlichen Körper Das
Einatmen der Dämpfe
führt zu Schleimhautreizungen, Kopfschmerzen oder
Übelkeit. Die innere Einnahme verursacht Verdauungsstörungen
und Krämpfe bis hin zur Atemlähmung. Die tödliche Dosis
liegt bei etwa fünf Gramm. Bei Vergiftungen können Blut-,
Leber- oder Nierenschäden auftreten. Naphthalin wirkt auch augen-
und hautreizend, und es besteht der Verdacht einer krebserzeugenden
Wirkung.
Es sind Fälle von Bauchspeicheldrüsenkrebs bekannt, die
möglicherweise auf Naphthalin zurückzuführen sind. Der
Aromat entsteht bei der Verbrennung von Tabak und befindet sich im
Zigarettenrauch. Naphthalin kommt auch als Wohngift vor, wenn
Parkettböden mit einer wasserabweisenden Teerfarbe abgedichtet
wurden.
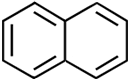
Eigenschaften Naphthalin
bildet farblose, glänzende Kristallplättchen, die einen
teerartigen Geruch nach Mottenkugeln aufweisen. Der Aromat verdampft
schon bei Raumtemperatur. Die entstehenden Dämpfe sind leicht
entzündbar. Früher wurde Naphthalin in Mottenkugeln verwendet.
In der Natur kommt der Aromat
vor allem in der Steinkohle vor. Bestimmte Pflanzen wie Magnolien
produzieren Naphthalin, um Insekten zu vertreiben. Sogar im Sekret der
Thermiten wurde Naphthalin nachgewiesen. Naphthalin löst sich nur
in Spuren im Wasser und ist in den meisten organischen
Lösungsmitteln gut löslich. Es ist sehr leicht sublimierbar
und mit Wasserdampf flüchtig. Wie Benzol verbrennt es mit stark rußender Flamme.
 |
| Herstellung Naphthalin
wird hauptsächlich aus dem Steinkohleteer gewonnen. Dieser kann
bis zu 10 Prozent Anteil enthalten. Bei der Destillation des
Steinkohleteers findet sich das Naphthalin im Mitteldestillat. |
| Verwendung Früher war
Naphthalin in Mottenkugeln zur Bekämpfung von Ungeziefer in
Kleiderschränken enthalten. Die insektentötende Wirkung war
aber nicht besonders gut. Wahrscheinlich beruhte die Wirkung auf dem
penetranten Geruch, der Insekten vertreibt. Es wird heute wegen seines
gefährlichen Potenzials für die Gesundheit nicht mehr für
Mottenkugeln verwendet.
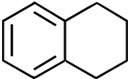
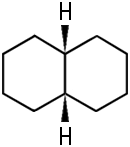
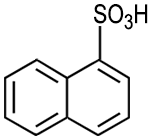
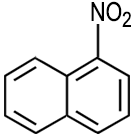
Naphthalin ist ein bedeutender Grundstoff der chemischen Industrie: Es dient zur Herstellung von Phthalsäure, Phthalsäureanhydrid, 1-Naphthol, 1-Naphthylamin, Tetralin, Decalin, Sulfonsäuren und Nitronaphthalinen. Damit ist es auch ein Grundstoff für die Herstellung von Azofarbstoffen, Insektiziden und Weichmachern. |