Ausgangsstoff
für die Titandioxidproduktion ist das Titan-Eisenerz Ilmenit,
ein schwärzlich glänzendes Mineral mit der chemischen Formel
FeTiO3, welches meist mit dem magnetisierbaren Eisenerz Magnetit
(Eisenoxid) und anderen Begleitmineralien als Gangart vermischt ist. Statt
Ilmenit wird manchmal auch das seltenere und weniger eisenhaltige Titan-Erz
Rutil TiO2 verwendet.
Die Förderung des Erzes erfolgt
im Tagebau, die wichtigsten Lagerstätten in Europa kommen in
Norwegen in Ekersund-Soggendal), sowie in Finnland und im Ilmengebirge
im südlichen Ural vor. Weitere Lagerstätten finden sich in Kanada, USA und in Australien.
Erzaufbereitung
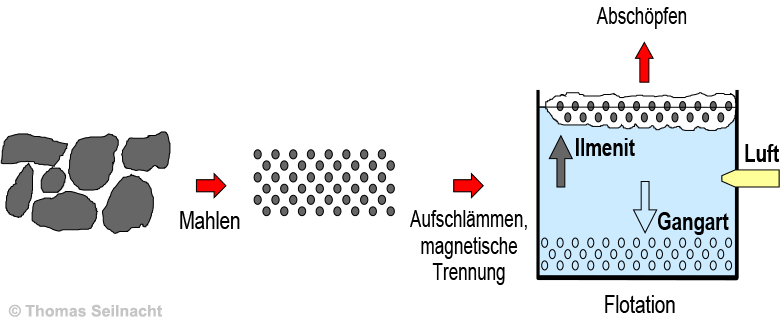
Das Erz wird zunächst
zu kleinen, etwa zwölf Millimeter großen Stücken zerbrochen
und dann in ein feines Pulver zermahlen. Die
im Erz enthaltenen Sulfide und vor allem auch der Magnetit werden in einem
aufwändigen Verfahren abgetrennt. Das pulverisierte Mineralgemisch wird
mit Hilfe einer Aufschlämmung in Wasser getrennt. Dabei schweben die
Teilchen mit höherer Dichte schneller an den Boden, so dass der leichtere
Ilmenit abgeschöpft werden kann. Starke Elektromagnete ziehen den
Magnetit heraus. Um das Mineral vollständig
von seiner Gangart zu trennen, wird es einem Flotationsprozess unterzogen:
Das Pulver wird in große, mit Wasser gefüllte Becken gegeben,
danach setzt man fettsäurehaltige Flotationschemikalien hinzu.
Diese umhüllen die feinen Mineralteilchen mit einer sehr dünnen
Schicht und machen sie schwer benetzbar. Durch das Einblasen von
Luft heften sich feine Luftbläschen an die umhüllten Mineralteilchen
und schwemmen diese trotz ihrer höheren Dichte als Wasser nach oben,
wo sie Schaum bilden und mit einem rotierenden Rechen abgesammelt werden,
während die Gangart zu Boden sinkt. Nach Abtrennung der Flotationschemikalien
erhält man aus dem ursprünglich 18%igen Erz ein Ilmenit-Konzentrat
mit einem Titandioxidanteil von rund 45%.
Aufbereitung des Ilmenit-Erzes
|
|
Der Magnetit in der Gangart muss vom Ilmenit abgetrennt werden.
|
Herstellung
nach dem Sulfatverfahren
Das 1915 von den Norwegern
F. Farup und Dr. G. Jebsen entwickelte Verfahren zur Titandioxidherstellung
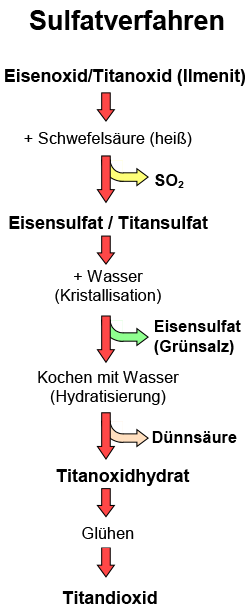
wird seit 1919 industriell angewandt und ist bis heute von Bedeutung. Das feingemahlene und angereicherte Titanerz
wird mit konzentrierter Schwefelsäure
aufgeschlossen, dabei reagiert das im Erz enthaltene Eisenoxid zu Eisensulfat,
das Titanerz zu Titansulfat. Bei diesem Prozess entstehen große Mengen
an Schwefeldioxid, welches mit Natronlauge aber weitgehend neutralisiert
wird, so dass heute nur noch verhältnismäßig wenig Schwefeldioxid
in die Umwelt gelangt. Die Abtrennung des Eisensulfats
vom Titansulfat erfolgt durch Kristallisation. Aufgrund seiner besseren
Wasserlöslichkeit kristallisiert das Eisensulfat zu grünem Eisen(II)-sulfat
aus, so dass es abgetrennt werden kann. Durch das Kochen in großen
Kesseln mit Wasser zerfällt das Titansulfat relativ leicht wieder
in Titanoxidhydrat, welches nach einem aufwendigen Waschprozess in einem
großen, drehbaren Rohr-Ofen bei 800 bis 1000 °C zu reinweißem
Titandioxid geglüht wird.
Zur Verbesserung der
optischen und physikalischen Eigenschaften werden die feinen Pigment-Teilchen
mit verschiedenen Substanzen und Verfahren nachbehandelt. Es findet erneutes Waschen,
Mahlen oder Aufdampfen einer Schicht auf die Pigment-Teilchen statt.
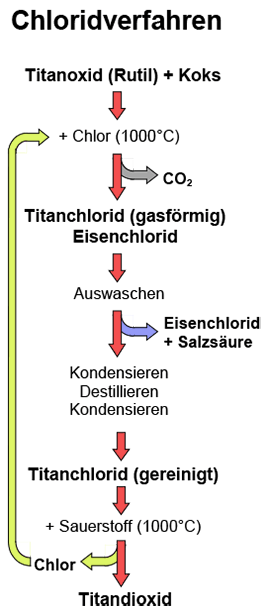
Herstellung
nach dem Chloridverfahren
Angereichertes Titanerz
oder Rutil wird mit Koks vermischt und in einem besonders chlorbeständigen
Wirbelschichtofen bei etwa 1000 °C mit Chlorgas vermischt. Dabei reagiert
das Chlor mit dem Titanoxid des Erzes und dem eingebrachten Kohlenstoff
zu gasförmigem Titantetrachlorid und Kohlenstoffdioxid:
Titandioxid + Kohlenstoff
+ Chlor  Titantetrachlorid
+ Kohlendioxid Titantetrachlorid
+ Kohlendioxid
TiO2 +
C + 2 Cl2  TiCl4 + CO2 TiCl4 + CO2
Bei der Chlorierung entstehendes
Eisen(II)-chlorid wird in Wasser gelöst und abgetrennt. Gleichzeitig
entsteht als Folge der Reaktion des Chlors mit der in der Schlacke enthaltenen
Restfeuchtigkeit Salzsäure, die
ausgewaschen wird und als Rohprodukt verkauft werden kann. Danach kondensiert
man das gasförmige Titanchlorid zu einem Feststoff und unterzieht
diesen einer nochmaligen Reinigung von Fremdstoffen durch Destillation. Nach erneutem Kondensieren
erhält man reines Titanchlorid, das der nächsten Verarbeitungsstufe
zugeführt werden kann. Das reine Titandioxid erhält man durch
Erhitzen des Titanchlorids auf hohe Temperaturen und einer Zugabe von reinem
Sauerstoff:
Titantetrachlorid
+ Sauerstoff  Titandioxid + Chlor
Titandioxid + Chlor
TiCl4 + O2  TiO2 + 2Cl2 TiO2 + 2Cl2
Dabei oxidiert
das Titanchlorid zu Titandioxid, wobei wieder reines Chlor frei wird, welches
in den Reaktionsprozess zurückgeführt wird.
| Vergleich der beiden Verfahren zur Titandioxidherstellung
|
|
|
|
Vergleich der
beiden Verfahren unter ökologischen Gesichtspunkten
Das Sulfatverfahren war
in der Vergangenheit aus verschiedenen Gründen oft in der umweltpolitischen
Diskussion, da dabei eine erhebliche Menge an Rückständen anfiel:
Beim Aufschluss des Titan-Eisenerzes mit Schwefelsäure
entstehen große Mengen an schwefelsäurehaltigen Rückständen,
die auch als Dünnsäure bezeichnet werden. Pro Tonne produziertem
Titandioxid nach dem Sulfatverfahren fallen etwa sechs bis acht Tonnen Dünnsäure
mit einer Schwefelsäurekonzentration von 20 bis 22 Prozent an. Die
Dünnsäure kann aufgrund ihres niedrigen Schwefelsäuregehalts
nicht mehr verarbeitet werden. In den 1950er-Jahren wurde sie in
die Flüsse geleitet und ab 1964 mit Schiffen in der Nordsee verklappt.
Die Dünnsäure ist meist mit Schwermetallsalzen wie Blei- oder
Chromsalzen verunreinigt. Der Cocktail stand im Verdacht, bei Fischen Flossenfäule
oder Geschwülste zu verursachen.
Das Ende der Dünnsäureverklappung
in der Nordsee wurde nach jahrelangen Verhandlungen und Aktionen durch
Einzelpersonen und Umweltschutzorganisationen gesetzlich durchgesetzt.
Seit 1990 sind die Titandioxidhersteller verpflichtet, Dünnsäure
aufzubereiten. Das Aufbereitungsverfahren wurde bereits 1958 von der Bayer
AG entwickelt und wird heute bei den meisten Titandioxidherstellern angewandt.
In einem relativ energieaufwändigen Prozesswerden der Säuregehalt erhöht
und Metallsalze wie Eisensulfat auskristallisiert. Die
dabei entstehende höher konzentrierte Schwefelsäure kann wieder
in das Verfahren zurückgeführt werden. Das Eisensulfat findet
als sogenanntes Grünsalz bei der Abwasseraufbereitung Verwendung.
Es kann die durch Düngemittel und Waschmittel
im Abwasser vorhandenen Phosphatsalze zu wasserunlöslichem Eisenphosphat
umwandeln, welche mit den üblichen Trennungsmethoden in den Kläranlagen
dann aus dem Wasser herausgeholt werden. Die bei der Titandioxidproduktion
anfallenden Eisenoxide werden zum Teil weiterverwertet oder gelagert.
Der wesentliche Vorteil
des Chloridverfahrens besteht darin, dass kein Schwefeldioxid und keine
Dünnsäure anfallen, da das freiwerdende Chlor wieder in den
Chlorierungsprozess zurückgeführt wird. Der Reaktionsofen für
die Chlorierung besitzt jedoch nur eine Lebensdauer von etwa einem Jahr,
danach muss er in dreimonatiger Arbeit erneuert werden. Außerdem
können Pigmente mit Anatas-Struktur nach dem Chloridverfahren nicht
erzeugt werden. Pigmente aus dem Chloridverfahren mit der Rutil-Struktur
können aufgrund ihrer größeren Härte nicht in der
Textilindustrie eingesetzt werden, da sie beim Spinnen der Stofffaser die
Spinnmaschine zerstören würden. Die Rutil-Form besitzt allerdings
eine höhere Deckkraft als die Anatas-Form und gilt als abriebbeständiger.
Aus diesem Grunde besitzen heute beide Verfahren etwa den gleichen Stellenwert
auf dem Weltmarkt.
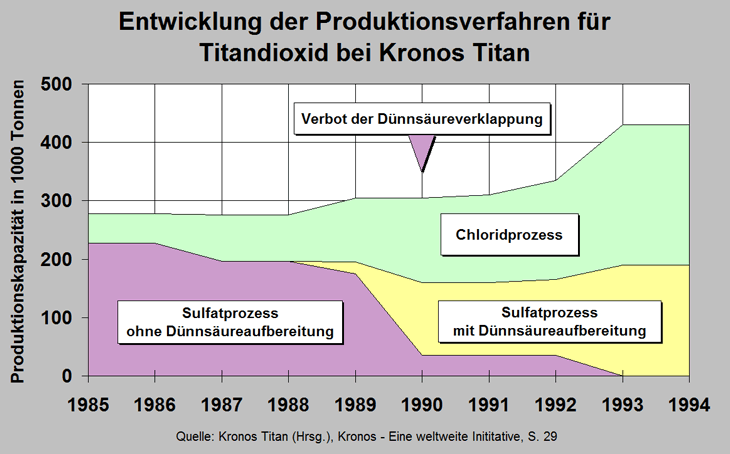
Die Grafik zeigt die
Entwicklung des Anteils der verschiedenen Herstellungsverfahren bei Kronos-Titan zwischen 1985 und 1994. Umweltfreundliche Produktionswege spielten zunehmend eine Rolle. Durch das Verbot der
Dünnsäureverklappung in der Nordsee wurde das Sulfatverfahren
ohne die Aufbereitung der Dünnsäure ganz eingestellt. Heute liegt
die Weltproduktion für Titandioxid bei über vier Millionen Tonnen.
1930 waren es noch 20000 Tonnen.
|