Die Fullerene stellen eine weitere Modifikation des Kohlenstoffs dar
| Elementarteilchen |
Atome |
Stoffportionen |
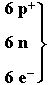
|
viele C
1 C
viele
C
|
|
| Kohlenstoff:
Diamant und Graphit im Vergleich Die Fullerene stellen eine weitere Modifikation des Kohlenstoffs dar |
||||||
|
|
Eigenschaft |
Graphit |
Diamant |
Erklärung |
|
Härte |
Graphit ist einer der weichsten Stoffe. | Diamant ist einer der härtesten Stoffe. | Die Kristallstrukturen und die Bindungen zwischen den Kohlenstoff-Atomen sind unterschiedlich. |
|
Kristallstruktur |
Synthetischer
Graphit kommt nur in der hexagonalen alpha- Modifikation vor (wabenförmige
ebene C-Schichten in ABAB- Reihenfolge).
In natürlichen Graphitvorkommen kann bis zu 30% in der rhombischen beta-Modifikation vorliegen (wabenförmige ebene C-Schichten in ABCABC- Reihenfolge). Vergleich der beiden Modifikationen: siehe unten Die wabenförmigen Schichten sind nur sehr locker an einander gebunden. Innerhalb der Schichten ist die Bindung zwischen den C-Atomen stark. |
Natürlicher
und synthetischer Diamant kristallisiert im kubischen System (Würfel,
Oktaeder, usw.) Zwischen allen C-Atomen ist eine sehr starke Bindung vorhanden. |
ABAB-Graphitgitter: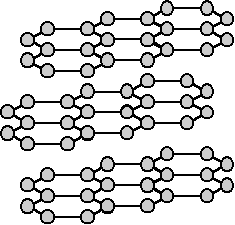
Diamantgitter: 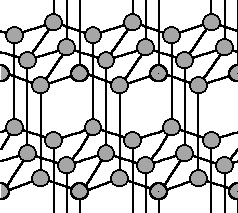
|
|
Farbe |
Es sind von Graphit nur schwarze Stoffproben bekannt. | Die Farbe von Diamanten variiert von farblos, transparent über verschiedene Farbtöne bis schwarz, undurchsichtig, je nach Verunreinigung. | Die Farbe wird auf die unterschiedliche Bindung zwischen den C-Atomen im Graphit (delokalisierte Bindung) bzw. im Diamanten (lokalisierte Bindung) zurückgeführt. |
|
Schmelzpunkt |
Graphit hat keinen Schmelzpunkt, sondern wird oberhalb 2500 °C plastisch verformbar. | Diamant
schmilzt bei 3800 bis 4440°C (je nach Quelle) und einem Druck zwischen 127 bar und 130000 bar. Unter 127 bar wandelt er sich in Graphit um. |
Bisher sind noch keine befriedigende Erklärungen vorhanden. |
|
Dichte |
Die Dichte variiert für amorphen Graphit von 1,8 bis 2,1 g/cm3, für kristallinen Graphit von 1,9 bis 2,3 g/cm3. | Die Dichte variiert von 3,150 bis 3,513 g/cm3. | Die Dichteschwankungen sind ungewöhnlich und bisher noch nicht befriedigend erklärt. |
|
Wärme- leitfähigkeit |
Die Wärmeleitfähigkeit von Graphit ist etwa so schlecht wie Mangan. | Die Wärmeleitfähigkeit von Diamant ist sehr gut (etwa zwei- bis fünfmal größer als Silber und fünf- bis achtmal größer als Gold). | Es liegen völlig verschiedene Wärmeleitungsmechanismen vor, die kompliziert zu erklären sind. |
|
Elektrische Leitfähigkeit |
Polykristalline Graphit-Proben leiten den elektrischen Strom wie Metalle (etwa 8 x schlechter als Mangan - das am schlechtesten leitende Metall). | Synthetische Diamanten sind Halbleiter, natürliche Diamanten sind entweder sehr gute Isolatoren oder starke elektrische Halbleiter. | Die gute Leitfähigkeit von Graphit wird auf die Bindungsverhältnisse innerhalb der wabenförmigen Kohlenstoffebenen zurückgeführt. Die Leitfähigkeit der Diamanten ist noch nicht befriedigend verstanden. |
|
Löslichkeit |
Graphit löst sich besser als Diamant in Metallschmelzen (besonders Eisen, aber auch Kobalt, Nickel, Chrom und Platin). | Diamant löst sich schlechter als Graphit in Metallschmelzen (besonders Eisen, aber auch Kobalt, Nickel, Chrom und Platin). | Die Unterschiede in der Löslichkeit sind noch nicht befriedigend verstanden. |
| Datenquellen
CRC-Handbook of Chemistry and Physics, 99. Auflage, CRC-Press, 2018 J. Emsley: The Elements, 2. Auflage, Oxford: Clarendon-Press, 1991 Holleman/Wiberg: Lehrbuch der anorganischen Chemie, 102. Auflage, Berlin/New York: de Gruyter, 2007 In der vorstehenden Tabelle wurde von zwei Stoffen gesprochen. Diese Verwendung des Begriffs ‚Stoff‘ stimmt in diesem Fall nicht mit der üblichen Verwendung überein, nach der Eis, flüssigesWasser und Wasserdampf ein Stoff sein sollen, für den die Umwandlungspunkte von 0°C und 100°C (bei Normaldruck) charakteristisch sind. Nach dieser üblichen Sprechweise sind Graphit und Diamant ein Stoff; als charakterische Stoffeigenschaften für diesen einen Stoff können dann Tripelpunkte für CGraphit/CDiamant/Cgas bei 4492°C und 10,3 MPa, bzw. für CGraphit/CDiamant/Cfl bei 3830 bis 3930°C bei 12 bis 13 GPa gewählt werden. |