 Teflonverschluss |
 Hellgelbe Kristalle oder Blättchen |
Molmasse 229,104 g/mol AGW 0,1 mg/m3 E (TRGS 900) Dichte 1,763 g/cm3 Schmelzpunkt +121 °C Explosion +300 °C Wasserlöslichkeit Konz. bei 20 °C 14 g/l Flammpunkt +150 °C |
| Piktogramme GHS 01 GHS 06 Gefahr |
Gefahrenklassen
+ Kategorie Explosive Stoffe 1 Akute Toxizität oral 3 Akute Toxizität dermal 3 Akute Toxizität inhalativ 3 |
HP-Sätze (siehe auch Hinweis) H 201, 301, 311, 331 P 210, 230, 250, 261, 264.1, 280.1-4+7, 301+310, 304+340, 372 Entsorgung besondere Hinweise |
| Dt. Bezeichnung Synonyme (deutsch) |
Engl. Bezeichnung Synonyme (engl.) |
|
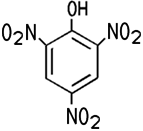
| CAS 88-89-1 | Pikrinsäure 2,4,6-Trinitrophenol |
Picric acid 2,4,6-Trinitrophenol |
Bemerkung
für Schulen: Pikrinsäure ist ein
Explosivstoff. Trockene Pikrinsäure kann schon durch Reibung
explodieren. Eine Aufbewahrung an Schulen ist nicht erlaubt.
Wirkung auf den menschlichen Körper Pikrinsäure reizt
Augen und Schleimhäute. Bei Hautkontakt entsteht eine anhaltende Gelbfärbung,
die Aufnahme in den Körper kann durch Hautresorption erfolgen. Bei
wiederholter Einwirkung treten Hautentzündungen auf. Beim Verschlucken
treten Erbrechen, Durchfall, Kopfschmerzen, Schwindel und Krämpfe
auf. Im Urin finden sich später dunkle Ausscheidungen. Nierenschäden
sind möglich. Der auftretende Brechreiz ist sehr stark, dadurch kommen
tödliche Vergiftungen eher selten vor. Das Einatmen der Stäube
verursacht in höheren Konzentrationen Bronchitis mit Fieber, Kopfschmerzen
und Schwindel. Bewusstlosigkeit und Nierenfunktionsstörungen können
folgen.
 Pikrinsäure: Mit viel Wasser angefeuchtete Kristalle Eigenschaften Reine
Pikrinsäure
bildet hellgelbe Kristalle oder Blättchen. Sie
schmecken bitter und
sind geruchlos. Sie lösen sich nur wenig in
kaltem Wasser mit intensiv gelber
Farbe unter Bildung einer sauren Lösung. In
heißem Wasser steigt die Löslichkeit. Seide, Wolle und Leder
werden von der Lösung gelb gefärbt.
In Ethylalkohol, Benzol und vor allem in Aceton ist
Pikrinsäure sehr
gut löslich. Die Nitrogruppen wirken als Chromophor. Dadurch ist die Pikrinsäure farbig. Die wässrige Pikrinsäurelösung zeigt eine intensive Gelbfärbung. Beim plötzlichen Erhitzen auf etwa 300 °C oder durch Schlag können die Kristalle explodieren. Aus diesem Grunde ist die Pikrinsäure des Handels immer mit Wasser angefeuchtet. Beim vorsichtigen Entzünden an der Luft verbrennt sie mit stark rußender Flamme, bei Initialzündung detoniert sie heftig und entfaltet eine Detonationsgeschwindigkeit von etwa 7,3 Kilometer pro Sekunde. Dieser Wert liegt über dem TNT und entspricht in etwa dem von Nitroglycerin. Pikrinsäure ist eine relativ starke Säure, sie greift Metalle unter Bildung ihrer Salze an. Die dabei entstehenden, explosiven Pikrate sind sehr berührungsempfindlich. Ammoniumpikrat wurde früher als Explosivstoff eingesetzt, Bleipikrat war in Zündsätzen enthalten. |
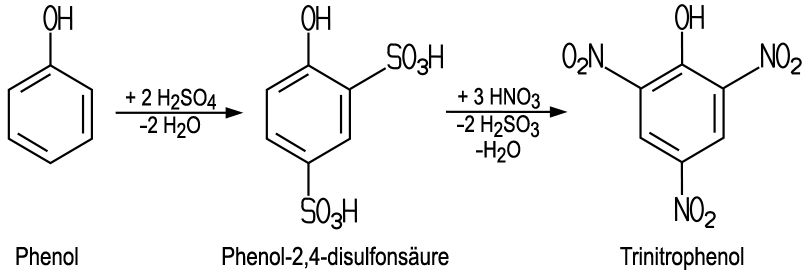
| Herstellung Die industrielle Herstellung
von Pikrinsäure erfolgt durch Nitrierung der Phenol-2,4-disulfonsäure mit Salpetersäure.
Dieses Zwischenprodukt erhält man durch eine Sulfonierung des Phenols mit konzentrierter Schwefelsäure.
 Eine Synthese wäre
auch in einer ähnlichen Reaktion aus Salicylsäure oder Acetylsalicylsäure möglich. Bei der Reaktion dieser Säuren
mit konzentrierter Schwefelsäure entsteht eine Phenolsulfonsäure. |
| Verwendung Früher wurde die
Pikrinsäure als Farbstoff zur Herstellung von gelber Tinte, zum Färben
von Seide und als Beizmittel in der Textil- und Lederindustrie benötigt.
Der Einsatz in kosmetischen Mitteln oder als Antiseptikum ist nicht mehr
gebräuchlich. Im Ersten Weltkrieg waren
Granaten mit Pikrinsäure als Explosivstoff gefüllt. Eine längere
Lagerung war aber aufgrund der Pikratbildung mit dem Metall der Hülsen
problematisch. Als Ersatz verwendete man dann später das chemisch
stabilere TNT.
Heute dient Pikrinsäure in der chemischen Industrie als Zwischenprodukt zur Herstellung von Pikraminsäure und damit als Ausgangsstoff für Azofarbstoffe. Im chemischen Labor wird sie zum Nachweis von Alkaloiden oder von Aromaten und Aminen benötigt. In der Mikroskopie dient sie zum Anfärben von Präparaten. Sie eignet sich auch zum Ätzen metallischer Oberflächen. Seide mit Pikrinsäure gefärbt (Stoffprobe aus dem Jahr 1868) |